有価証券報告書-第22期(令和2年1月1日-令和2年12月31日)
研究開発活動
当連結会計年度における研究開発費は3,796百万円(前年同期比15億81百万円(+71.4%)の増加)となりました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子治療を中心に医薬品開発に取り組んでおります。中でも2019年末から拡大している新型コロナウイルス感染症に関しては、予防用のワクチンと治療薬の二軸で、国内外で開発を進めております。また、究極の遺伝子治療であるゲノム編集においては、先進の技術を持つEmendo社を完全子会社とし、共にゲノム編集技術で、いままで治療法のなかった患者にお届けできる医薬品開発を進めてまいります。
2019年9月に製品化したHGF遺伝子治療用製品「コラテジェン®」は、適応拡大及び米国での承認を目指して、国内外で臨床試験を実施しております。導出に向けた活動も積極的に行い、トルコのEr-Kim社と独占販売契約を締結いたしました。椎間板性腰痛症を対象としてNF-κBデコイオリゴDNAや高血圧向けDNAワクチンの開発も継続して行っております。
当社は、海外企業との提携も積極的に行い、有望な医薬品の実用化に向けて共同開発を進めております。

■新型コロナウイルス感染症予防DNAワクチン(自社品)
当社は、プラスミドDNAの技術を用いて2020年3月より大阪大学と共同で新型コロナウイルス感染症に対する予防用ワクチンの開発を開始し、現在第Ⅱ/Ⅲ相臨床試験を実施しております。
■新型コロナウイルス感染症治療薬(共同開発品)
当社は、カナダのバイオ医薬品企業であるVasomune社と急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品に関する共同開発契約を締結し、現在AV-001を新型コロナウイルス感染症治療薬として、2020年12月より健康成人を対象とした第Ⅰ相臨床試験を米国において実施し、安全性と忍容性を認め、良好な結果を確認しました。引き続き、第Ⅱ相臨床試験の準備を進めます。
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症の潰瘍の改善効能効果で条件及び期限付承認を取得し、2019年9月10日より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」といいます。)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、製造販売後承認条件評価を2024年までに行い、本承認取得を目指してまいります。海外開発については、米国において2020年1月より、下肢潰瘍を有する閉塞性動脈硬化症を対象とした第Ⅱb相臨床試験を実施しております。
⦅対象疾患:慢性動脈閉塞症における安静時疼痛⦆
「コラテジェン®」の適応拡大を目的として、国内において慢性動脈閉塞症における安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より開始しております。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(自社品)⦆
核酸医薬NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めております。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験は、投与後の観察期間6カ月間を経た結果として、患者の忍容性は高いうえ、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛に著しい軽減とその効果の持続が認められ、有効性も確認できました。今後12ヵ月後までの結果を踏まえて、第Ⅱ相臨床試験へ移行することとなります。
核酸医薬デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイオリゴDNAの研究を行っており、NF-κBとSTAT6という2つの転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイオリゴDNAの作用に加えてさらに多くの炎症に関係する因子を抑制し幅広い作用を発揮することが期待されます。
■高血圧治療用DNAワクチン(自社品)
当社グループは、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、高血圧治療用DNAワクチンの開発を進めております。オーストラリアでの第Ⅰ/Ⅱa相臨床試験は投与後の初期の試験結果の評価を行ったところ、重篤な有害事象はなく、安全性に問題がないことを確認し、アンジオテンシンⅡに対する抗体産生を認めました。今後、安全性、免疫原性および有効性を評価する試験を継続的に行ってまいります。
新規研究開発プロジェクト及び新規事業プロジェクト
■ゲノム編集技術による遺伝子治療用製品開発
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社へ追加出資し、完全子会社化しました。Emendo社のゲノム編集技術は、高い効率で正確なゲノム編集を可能にする画期的かつ実用的な独自技術です。
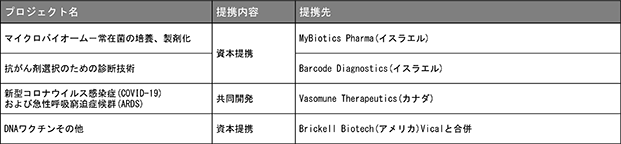
■マイクロバイオームを用いた疾患予防・健康維持
当社は、腸内細菌叢を利用した疾患治癒の薬品や健康維持のサプリメントについて開発しているイスラエルのMyBiotics Pharma Ltd.と2018年7月に資本提携し、1 人 1 人の健康状態・体質に合った腸内細菌を見つけ出し、それらを含む薬品やサプリメントを開発することを目指しています。
■診断事業への参入
当社は、事業基盤拡大を目的としイスラエルのバイオハイテク企業Barcode Diagnostics Ltd.が開発した、個々のがん患者にとって最適な抗がん剤を迅速に特定する診断技術の早期実用化に向け、2020年2月に公益財団法人がん研究会と共同研究契約を締結いたしました。
■Brickell Biotech,Inc.(旧:バイカル社)との戦略的な開発協力
当社と2016年12月に戦略的事業提携を締結したバイカル社は、2019年8月に米国のBrickell Biotech, Inc.との合併契約を締結し、合併後の新社名はBrickell Biotech, Inc.となりました。同社とは2020年9月に新型コロナウイルス感染症予防DNAワクチンの米国での臨床開発に関する共同開発契約を締結しました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子治療を中心に医薬品開発に取り組んでおります。中でも2019年末から拡大している新型コロナウイルス感染症に関しては、予防用のワクチンと治療薬の二軸で、国内外で開発を進めております。また、究極の遺伝子治療であるゲノム編集においては、先進の技術を持つEmendo社を完全子会社とし、共にゲノム編集技術で、いままで治療法のなかった患者にお届けできる医薬品開発を進めてまいります。
2019年9月に製品化したHGF遺伝子治療用製品「コラテジェン®」は、適応拡大及び米国での承認を目指して、国内外で臨床試験を実施しております。導出に向けた活動も積極的に行い、トルコのEr-Kim社と独占販売契約を締結いたしました。椎間板性腰痛症を対象としてNF-κBデコイオリゴDNAや高血圧向けDNAワクチンの開発も継続して行っております。
当社は、海外企業との提携も積極的に行い、有望な医薬品の実用化に向けて共同開発を進めております。

■新型コロナウイルス感染症予防DNAワクチン(自社品)
当社は、プラスミドDNAの技術を用いて2020年3月より大阪大学と共同で新型コロナウイルス感染症に対する予防用ワクチンの開発を開始し、現在第Ⅱ/Ⅲ相臨床試験を実施しております。
■新型コロナウイルス感染症治療薬(共同開発品)
当社は、カナダのバイオ医薬品企業であるVasomune社と急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品に関する共同開発契約を締結し、現在AV-001を新型コロナウイルス感染症治療薬として、2020年12月より健康成人を対象とした第Ⅰ相臨床試験を米国において実施し、安全性と忍容性を認め、良好な結果を確認しました。引き続き、第Ⅱ相臨床試験の準備を進めます。
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症の潰瘍の改善効能効果で条件及び期限付承認を取得し、2019年9月10日より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」といいます。)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、製造販売後承認条件評価を2024年までに行い、本承認取得を目指してまいります。海外開発については、米国において2020年1月より、下肢潰瘍を有する閉塞性動脈硬化症を対象とした第Ⅱb相臨床試験を実施しております。
⦅対象疾患:慢性動脈閉塞症における安静時疼痛⦆
「コラテジェン®」の適応拡大を目的として、国内において慢性動脈閉塞症における安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より開始しております。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(自社品)⦆
核酸医薬NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めております。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験は、投与後の観察期間6カ月間を経た結果として、患者の忍容性は高いうえ、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛に著しい軽減とその効果の持続が認められ、有効性も確認できました。今後12ヵ月後までの結果を踏まえて、第Ⅱ相臨床試験へ移行することとなります。
核酸医薬デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイオリゴDNAの研究を行っており、NF-κBとSTAT6という2つの転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイオリゴDNAの作用に加えてさらに多くの炎症に関係する因子を抑制し幅広い作用を発揮することが期待されます。
■高血圧治療用DNAワクチン(自社品)
当社グループは、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、高血圧治療用DNAワクチンの開発を進めております。オーストラリアでの第Ⅰ/Ⅱa相臨床試験は投与後の初期の試験結果の評価を行ったところ、重篤な有害事象はなく、安全性に問題がないことを確認し、アンジオテンシンⅡに対する抗体産生を認めました。今後、安全性、免疫原性および有効性を評価する試験を継続的に行ってまいります。
新規研究開発プロジェクト及び新規事業プロジェクト
■ゲノム編集技術による遺伝子治療用製品開発
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社へ追加出資し、完全子会社化しました。Emendo社のゲノム編集技術は、高い効率で正確なゲノム編集を可能にする画期的かつ実用的な独自技術です。
■マイクロバイオームを用いた疾患予防・健康維持
当社は、腸内細菌叢を利用した疾患治癒の薬品や健康維持のサプリメントについて開発しているイスラエルのMyBiotics Pharma Ltd.と2018年7月に資本提携し、1 人 1 人の健康状態・体質に合った腸内細菌を見つけ出し、それらを含む薬品やサプリメントを開発することを目指しています。
■診断事業への参入
当社は、事業基盤拡大を目的としイスラエルのバイオハイテク企業Barcode Diagnostics Ltd.が開発した、個々のがん患者にとって最適な抗がん剤を迅速に特定する診断技術の早期実用化に向け、2020年2月に公益財団法人がん研究会と共同研究契約を締結いたしました。
■Brickell Biotech,Inc.(旧:バイカル社)との戦略的な開発協力
当社と2016年12月に戦略的事業提携を締結したバイカル社は、2019年8月に米国のBrickell Biotech, Inc.との合併契約を締結し、合併後の新社名はBrickell Biotech, Inc.となりました。同社とは2020年9月に新型コロナウイルス感染症予防DNAワクチンの米国での臨床開発に関する共同開発契約を締結しました。
