有価証券報告書-第40期(平成25年4月1日-平成26年3月31日)
事業内容
(1)事業の内容について
当社グループは、当社と連結子会社のIna Research Philippines, Inc.(以下「INARP」と言います。)及びInaphil, Incorporated(以下「INAPHIL」と言います。)から構成されており、事業内容は「非臨床試験」、「臨床試験」、「環境」のセグメントから構成されております。
「非臨床試験」は、医薬品開発企業・食品関連企業から委託を受け、実験動物や細胞を用いて開発薬物や食品素材の安全性や有効性の確認を行う非臨床試験を実施しております。当社のサル試験に主として使用する実験用カニクイザルの多くは、INARPから供給されております。なお、INARPの事業用地はINAPHILが所有しており、INAPHILは、INARPの土地保有会社として設立された会社であります。
「臨床試験」においては、主に医薬品開発企業から開発薬物の循環器への副作用をヒトにより評価する試験を受託しております。
「環境」は、脱臭材搭載装置、殺菌装置、実験動物用機材の設計・販売等を行っております。
当社グループの事業系統図は次のとおりであります。
[事業系統図]
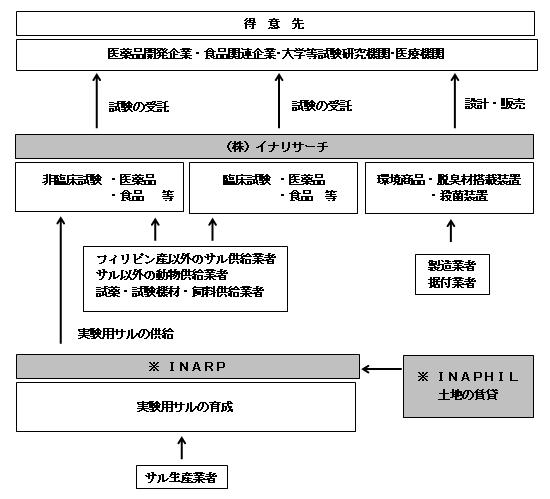 (注)※連結子会社
(注)※連結子会社
(2)「非臨床試験」について
新薬として市場で流通する医薬品は、次のような開発過程を経て販売されます。
[医薬品の開発過程]
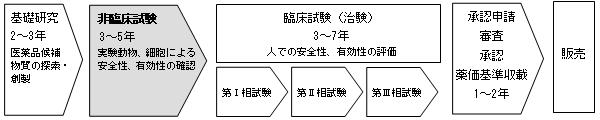
この開発過程において当社は医薬品開発企業の委託を受けて、非臨床試験段階の開発支援を行っております。非臨床試験は、探索・創製された医薬品候補物質を、マウス、ラット、ウサギ、イヌ、サル等の実験動物、細胞、細菌を用いて、その安全性や有効性を確認するものです。非臨床試験から得られた試験成績は、新薬の承認申請に際して必要な資料として薬事法に定められており、その後のステップである臨床試験(治験)において、ヒトに適用した場合の安全性に関する適切な情報を得るために不可欠な試験となっております。
新薬の承認申請の添付資料となる試験成績は、薬事法に規定されるGLP(注1)に適合した施設においてGLPに従い実施した試験から得られたデータを用いることが求められております。当社が新薬開発支援を目的とする非臨床試験を行うためには、GLP適合施設であることが不可欠であり、GLP施行以来9回のGLP適合性調査(注2)を受け、常に適合の評価を得ております。
委託者の試験依頼から最終報告書提出に至るまでの試験の流れは、以下のとおりであります。
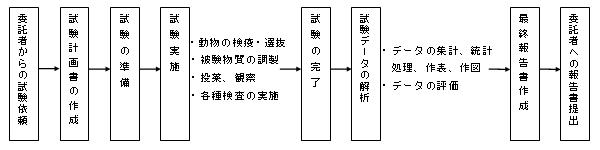
当社で実施する非臨床試験は、安全性試験(単回・反復投与毒性試験、生殖発生毒性試験、遺伝毒性試験等の毒性試験、依存性試験、安全性薬理試験、トキシコキネティクス試験)、薬効薬理試験及び薬物動態試験があり、試験の種類と内容は次のとおりであります。
[非臨床試験の種類と試験内容]
非臨床試験のうち、サル試験は当社グループの主力試験となっております。サルは、ヒトと生理学的、遺伝子的に類似性が高いことから、サル試験の有用性は非常に高いものと位置付けられております。
当社グループで使用するサルの多くはINARPにおいて育成し、実験用に適した品質のサルを使用しております。サルは、他の実験動物と比べ取り扱いが難しく、また、個体による生理学的なバラツキが大きいため安定したデータ採取が難しいことから、この点が試験精度に影響を与える要因となります。そのため、INARPでは、フィリピン国内のブリーダーにおいて繁殖されたサルを若齢のうちに入手し、Primate Quality Control Center(PQCC)において、微生物学的コントロール及び飼育環境や試験操作への馴化を行い、実験動物としての品質向上に取り組んでおり、より信頼性の高い試験データの提供に努めております。
サルの取得に関しては、当社グループは農林水産大臣による検疫施設の指定(注4)を受けており、フィリピンの現地ブリーダーからの買い付け、育成、輸出・輸入時の検疫までをグループ内で一貫して行うことができます。これにより、実験用として品質の優れたサルを安定的に確保する体制ができております。
(注1) GLP:医薬品GLPは「医薬品の安全性試験に関する非臨床試験の実施の基準(GLP:Good Laboratory Practice)」の略称で、医薬品の製造(輸入)承認申請の際に提出すべき資料のうち、動物による安全性試験データの信頼性を確保するために、試験実施施設が遵守しなければならない事項を定めた厚生労働省令であります。
(注2) GLP適合性調査:独立行政法人医薬品医療機器総合機構によりGLPに従って試験が行われているかを調査します。GLPが適用された試験について計画・実施等に関するすべての要素や過程(ハード面・ソフト面)について調査します。
(注3) 被験物質:試験において安全性の評価対象となる医薬品(医療機器を含む)または化学的物質、生物学的物質もしくはその製剤のことを言います。
(注4) 農林水産大臣の検疫施設の指定:平成10年に「感染症の予防及び感染症の患者に対する医療に関する法律」(感染症新法)が公布され、サルについてはエボラ出血熱等を対象として輸入検疫が義務付けられるようになりました。当社グループでは、当社が輸入検査場所としての指定を、INARPが日本向け輸出指定動物(霊長類)を取り扱う出国検疫施設の指定を受けております。
(3) 「臨床試験」について
新薬の開発過程において、非臨床試験の次のステップとして臨床試験(治験)に入ります。臨床試験は一般に、医薬品候補物質について少人数の健康成人で安全な投与量を決定するために実施する第Ⅰ相試験(臨床薬理試験)、少人数の患者でその有効性、安全性、使い方を調査するため実施する第Ⅱ相試験(探索的試験)、最後に第Ⅱ相試験で得られた情報をもとに投与対象患者を拡大して実施し、既存の標準的な医薬品(治療法)と比較を行いつつ新薬の有効性と安全性を精密に評価するために実施する第Ⅲ相試験(検証的試験)のステップを経て進められます。
また、医薬品の臨床試験は、GCP(注1)下において科学的かつ倫理的に実施することが義務付けられており、試験の実施にあたっては、治験審査委員会(注2)による試験毎の審査・監視及び被験者に対するインフォームド・コンセント(注3)が必要となります。
当社グループでは、この臨床試験において、比較的初期の段階で必要となるTQT試験の事業拡大を図っております。TQT試験は、1990年代に欧米で多発し社会問題となった薬害である致死性不整脈や危険な薬物誘発性QT延長の発生を防止するため、平成17年にICH(注4)にて制定された国際共通ガイドラインの中で実施が求められており、平成21年10月23日には厚生労働省医薬食品局よりTQT試験実施に関するガイドラインが発表されました。当社グループでは、心電図中央解析ラボの大手である米国 Cardiocore Lab,LLC. と業務提携契約を締結するとともに、国内臨床試験施設と協力して試験実施体制を構築し取り組んだ結果、大手製薬企業からの委託試験が売上となりました。大型試験も現在実施中であり、引続き事業の拡大に向けて取組んでまいります。
(注1) GCP:医薬品GCPは、医薬品の臨床試験の実施の基準(GCP:Good Clinical Practice)の略称で、臨床試験が倫理的な配慮のもとに科学的に実施されることを目的として定められた厚生労働省令であります。
(注2) 治験審査委員会:実施される臨床試験が科学的、倫理的に問題がないかを都度審査し、監視するための委員会であり、医療専門家、法律家、市民により構成されます。
(注3) インフォームド・コンセント:治験に参加するボランティア(被験者)に対して、治験の内容、それから得られる利益、不利益、副作用が発現するリスクなどについて十分な説明を行い、被験者が理解・納得したうえで、自らの意志により同意(文書同意)することをいいます。
(注4) ICH:International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use(日米EU医薬品規制調和国際会議)の略称で、国際間での新薬承認申請データを相互に活用できる環境を整え、他国の優れた医薬品の承認がスムーズにおこなえるようにすることを目的に、日・米・欧の薬事規制当局によって開催されている国際会議であります。
(4) 「環境」について
実験動物施設の運営を通し、長年にわたり培ってきた空気環境対策のノウハウを生かした脱臭システムの設計・販売を行っております。実験動物施設をはじめ、全国的に環境保全のための規制強化が進む中で、より良い空気環境を求める様々な業界に向け販売しております。
また、口蹄疫や鳥インフルエンザといった畜産業界・養鶏業界を根底から脅かす感染症についても、弱酸性殺菌水の生産・供給装置といったソリューションを提供しております。
さらに、実験動物用機材につきましても、自社での経験をもとに顧客の求める最適な機材を提供することを通じて販路を拡大しております。
当社グループは、当社と連結子会社のIna Research Philippines, Inc.(以下「INARP」と言います。)及びInaphil, Incorporated(以下「INAPHIL」と言います。)から構成されており、事業内容は「非臨床試験」、「臨床試験」、「環境」のセグメントから構成されております。
「非臨床試験」は、医薬品開発企業・食品関連企業から委託を受け、実験動物や細胞を用いて開発薬物や食品素材の安全性や有効性の確認を行う非臨床試験を実施しております。当社のサル試験に主として使用する実験用カニクイザルの多くは、INARPから供給されております。なお、INARPの事業用地はINAPHILが所有しており、INAPHILは、INARPの土地保有会社として設立された会社であります。
「臨床試験」においては、主に医薬品開発企業から開発薬物の循環器への副作用をヒトにより評価する試験を受託しております。
「環境」は、脱臭材搭載装置、殺菌装置、実験動物用機材の設計・販売等を行っております。
当社グループの事業系統図は次のとおりであります。
[事業系統図]
 (注)※連結子会社
(注)※連結子会社(2)「非臨床試験」について
新薬として市場で流通する医薬品は、次のような開発過程を経て販売されます。
[医薬品の開発過程]

この開発過程において当社は医薬品開発企業の委託を受けて、非臨床試験段階の開発支援を行っております。非臨床試験は、探索・創製された医薬品候補物質を、マウス、ラット、ウサギ、イヌ、サル等の実験動物、細胞、細菌を用いて、その安全性や有効性を確認するものです。非臨床試験から得られた試験成績は、新薬の承認申請に際して必要な資料として薬事法に定められており、その後のステップである臨床試験(治験)において、ヒトに適用した場合の安全性に関する適切な情報を得るために不可欠な試験となっております。
新薬の承認申請の添付資料となる試験成績は、薬事法に規定されるGLP(注1)に適合した施設においてGLPに従い実施した試験から得られたデータを用いることが求められております。当社が新薬開発支援を目的とする非臨床試験を行うためには、GLP適合施設であることが不可欠であり、GLP施行以来9回のGLP適合性調査(注2)を受け、常に適合の評価を得ております。
委託者の試験依頼から最終報告書提出に至るまでの試験の流れは、以下のとおりであります。

当社で実施する非臨床試験は、安全性試験(単回・反復投与毒性試験、生殖発生毒性試験、遺伝毒性試験等の毒性試験、依存性試験、安全性薬理試験、トキシコキネティクス試験)、薬効薬理試験及び薬物動態試験があり、試験の種類と内容は次のとおりであります。
[非臨床試験の種類と試験内容]
| 試験の種類 | 試験内容 | ||
| 安全性試験 | 毒性試験 | ||
| 単回投与毒性試験 | 被験物質(注3)を1回投与した時の毒性を、質的・量的の両面から調べます。 | ||
| 反復投与毒性試験 | 被験物質を繰り返し投与したときに生ずる毒性変化を用量及び時間との関連で把握し、明らかな毒性変化が認められる用量とその変化の内容、また毒性変化が認められない用量を調べます。 | ||
| 生殖発生毒性試験 | 生体の生殖機能に対して、被験物質が及ぼす悪影響があるかどうかを、親世代の生殖機能から次世代の成長・発達までの期間について調べます。 | ||
| 遺伝毒性試験 | 細胞や細菌を用いて、被験物質の遺伝子突然変異、染色体異常、DNA損傷を誘発する可能性を調べます。 | ||
| がん原性試験 | 被験物質の発がん性リスクを調べます。 | ||
| 局所刺激性試験 | 被験物質を皮膚、血管内、筋肉内等の限られた部位に適用して、その刺激性を調べます。 | ||
| 抗原性試験 | 被験物質がヒトに対してアレルギーを誘発する可能性があるかどうかを調べます。 | ||
| 皮膚感作(光感作)性試験 | 皮膚外用剤として用いる被験物質の皮膚に対する接触や光照射によるアレルギー誘発性を調べます。 | ||
| 依存性試験 | 中枢神経作用を有する被験物質の依存性を明らかにすると共に、乱用の可能性及び乱用された場合のリスクについて調べます。 | ||
| 安全性薬理試験 | 被験物質が、ヒトの生命維持機能に対する有害作用(副作用)があるかどうかを調べます。 | ||
| トキシコキネティクス試験 | 毒性試験に用いた動物から採血し、血液中の被験物質の濃度を調べ、全身暴露と発現された毒性症状を比較します。 | ||
| 薬効薬理試験 | 被験物質の薬としての有効性を評価します。ターゲットとする疾病の病態モデル動物を用いて評価します。 | ||
| 薬物動態試験 | 被験物質投与後の生体内での被験物質及びその代謝物質の吸収、分布、代謝、排泄について血液、尿、組織を採取して調べます。 | ||
非臨床試験のうち、サル試験は当社グループの主力試験となっております。サルは、ヒトと生理学的、遺伝子的に類似性が高いことから、サル試験の有用性は非常に高いものと位置付けられております。
当社グループで使用するサルの多くはINARPにおいて育成し、実験用に適した品質のサルを使用しております。サルは、他の実験動物と比べ取り扱いが難しく、また、個体による生理学的なバラツキが大きいため安定したデータ採取が難しいことから、この点が試験精度に影響を与える要因となります。そのため、INARPでは、フィリピン国内のブリーダーにおいて繁殖されたサルを若齢のうちに入手し、Primate Quality Control Center(PQCC)において、微生物学的コントロール及び飼育環境や試験操作への馴化を行い、実験動物としての品質向上に取り組んでおり、より信頼性の高い試験データの提供に努めております。
サルの取得に関しては、当社グループは農林水産大臣による検疫施設の指定(注4)を受けており、フィリピンの現地ブリーダーからの買い付け、育成、輸出・輸入時の検疫までをグループ内で一貫して行うことができます。これにより、実験用として品質の優れたサルを安定的に確保する体制ができております。
(注1) GLP:医薬品GLPは「医薬品の安全性試験に関する非臨床試験の実施の基準(GLP:Good Laboratory Practice)」の略称で、医薬品の製造(輸入)承認申請の際に提出すべき資料のうち、動物による安全性試験データの信頼性を確保するために、試験実施施設が遵守しなければならない事項を定めた厚生労働省令であります。
(注2) GLP適合性調査:独立行政法人医薬品医療機器総合機構によりGLPに従って試験が行われているかを調査します。GLPが適用された試験について計画・実施等に関するすべての要素や過程(ハード面・ソフト面)について調査します。
(注3) 被験物質:試験において安全性の評価対象となる医薬品(医療機器を含む)または化学的物質、生物学的物質もしくはその製剤のことを言います。
(注4) 農林水産大臣の検疫施設の指定:平成10年に「感染症の予防及び感染症の患者に対する医療に関する法律」(感染症新法)が公布され、サルについてはエボラ出血熱等を対象として輸入検疫が義務付けられるようになりました。当社グループでは、当社が輸入検査場所としての指定を、INARPが日本向け輸出指定動物(霊長類)を取り扱う出国検疫施設の指定を受けております。
(3) 「臨床試験」について
新薬の開発過程において、非臨床試験の次のステップとして臨床試験(治験)に入ります。臨床試験は一般に、医薬品候補物質について少人数の健康成人で安全な投与量を決定するために実施する第Ⅰ相試験(臨床薬理試験)、少人数の患者でその有効性、安全性、使い方を調査するため実施する第Ⅱ相試験(探索的試験)、最後に第Ⅱ相試験で得られた情報をもとに投与対象患者を拡大して実施し、既存の標準的な医薬品(治療法)と比較を行いつつ新薬の有効性と安全性を精密に評価するために実施する第Ⅲ相試験(検証的試験)のステップを経て進められます。
また、医薬品の臨床試験は、GCP(注1)下において科学的かつ倫理的に実施することが義務付けられており、試験の実施にあたっては、治験審査委員会(注2)による試験毎の審査・監視及び被験者に対するインフォームド・コンセント(注3)が必要となります。
当社グループでは、この臨床試験において、比較的初期の段階で必要となるTQT試験の事業拡大を図っております。TQT試験は、1990年代に欧米で多発し社会問題となった薬害である致死性不整脈や危険な薬物誘発性QT延長の発生を防止するため、平成17年にICH(注4)にて制定された国際共通ガイドラインの中で実施が求められており、平成21年10月23日には厚生労働省医薬食品局よりTQT試験実施に関するガイドラインが発表されました。当社グループでは、心電図中央解析ラボの大手である米国 Cardiocore Lab,LLC. と業務提携契約を締結するとともに、国内臨床試験施設と協力して試験実施体制を構築し取り組んだ結果、大手製薬企業からの委託試験が売上となりました。大型試験も現在実施中であり、引続き事業の拡大に向けて取組んでまいります。
(注1) GCP:医薬品GCPは、医薬品の臨床試験の実施の基準(GCP:Good Clinical Practice)の略称で、臨床試験が倫理的な配慮のもとに科学的に実施されることを目的として定められた厚生労働省令であります。
(注2) 治験審査委員会:実施される臨床試験が科学的、倫理的に問題がないかを都度審査し、監視するための委員会であり、医療専門家、法律家、市民により構成されます。
(注3) インフォームド・コンセント:治験に参加するボランティア(被験者)に対して、治験の内容、それから得られる利益、不利益、副作用が発現するリスクなどについて十分な説明を行い、被験者が理解・納得したうえで、自らの意志により同意(文書同意)することをいいます。
(注4) ICH:International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use(日米EU医薬品規制調和国際会議)の略称で、国際間での新薬承認申請データを相互に活用できる環境を整え、他国の優れた医薬品の承認がスムーズにおこなえるようにすることを目的に、日・米・欧の薬事規制当局によって開催されている国際会議であります。
(4) 「環境」について
実験動物施設の運営を通し、長年にわたり培ってきた空気環境対策のノウハウを生かした脱臭システムの設計・販売を行っております。実験動物施設をはじめ、全国的に環境保全のための規制強化が進む中で、より良い空気環境を求める様々な業界に向け販売しております。
また、口蹄疫や鳥インフルエンザといった畜産業界・養鶏業界を根底から脅かす感染症についても、弱酸性殺菌水の生産・供給装置といったソリューションを提供しております。
さらに、実験動物用機材につきましても、自社での経験をもとに顧客の求める最適な機材を提供することを通じて販路を拡大しております。