訂正有価証券届出書(新規公開時)
事業内容
当社は、アプタマー創薬技術に関するプラットフォームである「RiboARTシステム(Ribomic Aptamer Refined Therapeutics System)」をベースとした創薬事業を展開している創薬プラットフォーム系バイオベンチャーであります。
「RiboARTシステム」は様々なアプタマー医薬の開発に応用できるものですが、当社は、特に「Unmet Medical Needs」疾患領域に的を絞り、医療機関や患者様から求められている新薬の提供を目指しております。
アプタマーとは核酸であるRNA※1を素材とした分子で、多様な立体構造を形成できるというRNAの特性を利用して、病気の要因となるタンパク質に結合してその働きを阻害あるいは調節します。その名称については、標的にフィットするという意味のラテン語の「aptus」が由来となり「アプタマー」と呼ばれております。
当社は、RNAの生化学的性質の把握、特に潜在的なRNAの造形力※2の掘り起こし、アプタマーの構想・デザイン、アプタマーの創製から医薬候補アプタマーの仕上げまでをカバーする「RiboARTシステム」をアプタマー創薬の基盤技術として確立しております。この「RiboARTシステム」は、様々な疾患分野や創薬ターゲットに対して応用可能な汎用性を有する創薬基盤技術です。自社で特定の新薬開発を行うのみならず、他の製薬会社の要請に応じて新薬のシーズ(タネ)を供与できるバイオベンチャーであることから、当社自身のことを「創薬プラットフォーム系バイオベンチャー」であると定義しております。
「RiboARTシステム」の概念図は以下のとおりです。
⦅RiboARTシステムの概念図⦆
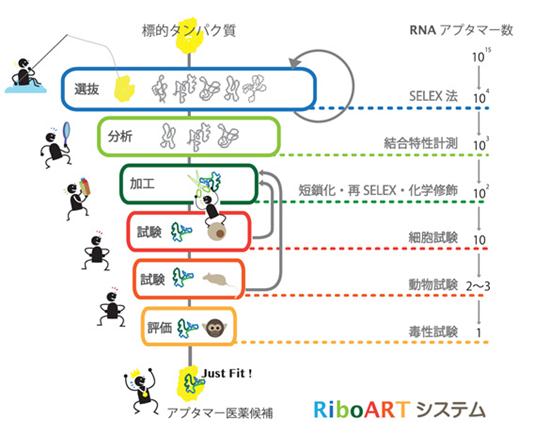
このような「RiboARTシステム」をベースとして、当社は、早期ライセンス・アウト※4を前提とした「自社創薬」と、製薬会社との「共同研究」の二つをバランス良く組合せて実行することを、事業展開の基本方針としております。
当社の事業の系統図は以下のとおりです。
⦅事業の系統図⦆
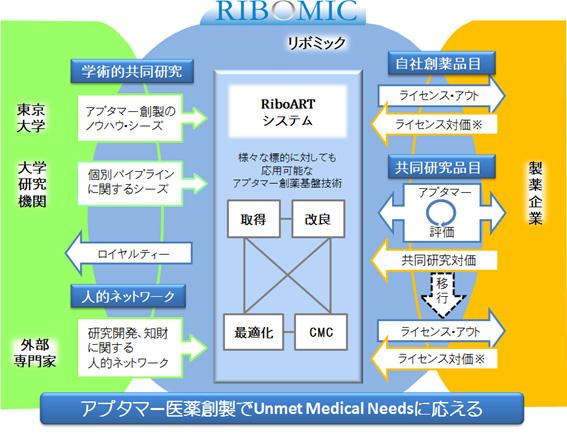
※:ライセンス対価には、当社が製薬企業より受け取る①契約締結時の一時金、②開発の進捗に応じたマイルストーン収入※5、③製品発売後の売上に対するロイヤルティーがあります。
創薬事業における共同研究では、アドバイザリー契約の下、アプタマー医薬開発に関する試験研究の受託、技術指導も実施しております。
また、当社は、上記の創薬事業に付随する事業として、医薬品以外への応用可能性を秘めたアプタマーの実用化検討も行っており、その一環として、抗体※6であるIgGに特異的に結合する性質を有したアプタマーを、工業用資材(抗体医薬※6の精製剤等)として開発することを目的に、大手化学品商社を窓口として製薬企業との協議を行っております。
(1)アプタマー医薬
ます。しかし、細胞内に入らなければ効果を発揮しない他の核酸医薬とは異なり、細胞内に導入する必要がないので非常に効率的です。アプタマー医薬としてこれまでに上市された製品は、2004年12月に米国食品医薬品局(FDA)が承認した「MacugenⓇ」(加齢黄斑変性症※8に対する治療薬)のみで、アプタマー医薬の市場は未開拓の領域といえます。
②医薬品市場におけるアプタマー医薬
(i)医薬品市場
IMS Health 社等の調査では、2012年の世界医薬品市場は約9,621億ドルで、2015年には1兆810億ドル、2020年には1兆3,180億ドルになると予想されています(参考資料1,2)。
着実に成長する医薬品市場の中で、現在の新薬開発の大きなトレンドは抗体医薬です。抗体医薬は30年を超える開発の歴史を有し、国立医薬品食品衛生研究所の調べでは、現在、日米欧で40を超える品目が承認され販売されています。
2003年の抗体医薬の売上高は52億ドルでしたが、2011年には421億ドルに拡大し、2015年には560億ドルになると予想されています (参考資料3)。
抗体医薬の開発に立ち遅れた日本の大手製薬企業は、2007年以降、欧米の抗体医薬開発ベンチャーを買収するなどの手段により、この市場に参入を始めました。現在、全世界で数百件の抗体医薬の臨床試験※9が進行しており、さらに市場規模が拡大すると当社は考えております。
しかし、抗体医薬は開発・製造コストが高く、医療費を圧迫する要因であると指摘され、抗体医薬に続く次世代新薬として核酸医薬が期待されています。
(ⅱ) 核酸医薬の市場
核酸を成分とする医薬品は「核酸医薬」と呼ばれ、新規な創薬技術として、低分子、ワクチン、生物製剤(特に抗体)に続く第4の柱となりつつあります。核酸医薬の中で最も早く開発が進んだのはアンチセンスです。
アンチセンスは1980年代の後半から世界的な開発ブームが起き、欧米のバイオベンチャーを主体として様々なアンチセンス薬が開発されてきました。しかし、開発に成功したのは1998年8月に米国FDAの承認を得たサイトメガロウイルスによる網膜症を適用疾患とするISIS社の「VitraveneⓇ」のみでした。
アンチセンスは細胞の中で作用するため、細胞内にアンチセンス薬を運ぶ仕組み、方法(ドラッグ・デリバリー・システム(DDS))がないと効果を発揮できません。このDDSの困難さがアンチセンスの開発を大きく阻害してきました。因みに、「VitraveneⓇ」は眼球内投与の薬剤です。
2013年1月、約15年の歳月を経て二番目のアンチセンス薬として、家族性高脂血症薬の「KynamroⓇ」が米国FDAで承認され、全身投与(静注や筋注、皮下注など全身への薬剤の移行を伴う投薬方法)の核酸医薬が初めて実現しました。
世界で最初に承認された抗体医薬は、腎移植後の急性拒絶反応を適応症とするマウス抗体であり、1986年に承認されました。二番目の抗体医薬(キメラ抗体)が承認されたのは1994年で、それまでに約8年を要しています。以降、ヒト化抗体(1997年)、抗体の一部を利用した抗体断片(1998年)、ヒト抗体(2002年)、コンジュゲート抗体などの技術革新を背景に製品開発が進み、市場が拡大したという経緯があります。
核酸医薬もDDSや疾患関連遺伝子やタンパク質の制御に関する技術革新に伴って、抗体医薬と同様の展開をたどると、当社は予測しております。
アプタマーを含む核酸医薬の市場は、2011年のシードプラニング社の調査では、2010年では20億円、2015年には300億円、2020年には5,000億円になると予測しています(参考資料4)。しかし、この予測は現在開発中の核酸医薬の開発の進捗状況、製品上市の時期、当該品目の市場性等により大きく変動する可能性があります。
核酸医薬には、アプタマーの他に、アンチセンス、デコイ、siRNA、microRNAなどの種類があります。現在の開発の主流はアンチセンスですが、依然として幾つかの課題(化学修飾、DDS及び製造と品質管理)が指摘されています。
今後、核酸医薬の中軸を担うのは、化学修飾が容易で細胞内へのDDS技術が不要であり、抗体と類似した作用メカニズムを持ち、応用範囲の広いアプタマー医薬だと、当社は考えております。
(ⅲ) アプタマー医薬の現状と課題
2004年12月、世界初のアプタマー医薬で、眼科領域の疾患である加齢黄斑変性症を適応症とする「MacugenⓇ」が米国FDAに承認され、逐次世界各国で承認を得て、世界的な製薬企業であるファイザー社から発売されました。なお、日本では2008年10月に発売されています。
市販1年目の2005年には米国だけで200億円近い売上を計上しました。しかし、翌年の2006年には、競合品の抗体医薬「LucentisⓇ」の上市により市場が奪われたことにより売上が急激に低下し、現在の売上は全世界で10数億円程度と思われます。
現時点では、アプタマー医薬で市販されているのは、「MacugenⓇ」のみです。PⅡ(フェーズⅡ試験)~PⅢ(フェーズⅢ試験)の後期臨床ステージにある開発中の製品は増加していますが、その数は抗体に比較すると些少です。
アプタマー医薬の開発が抗体医薬ほどに進まず、製品化が遅れている主な理由として、以下の二つが考えられます。一つは、アプタマーの創製に不可欠な技術であるSELEX法(後述)に関する基本特許が米国のアルケミックス社に押えられ、日米欧の製薬会社がアプタマー創薬のための研究活動を自由にできなかったことです。二つ目は、アルケミックス社と提携した場合も、アルケミックス社がアプタマーの創製を独占した結果、医薬品化に必要なアプタマーの最適化※10(改変・改良等)を十分に行えず、臨床ステージに上げられるアプタマーの創製に到達できなかったことです。
アルケミックス社と提携した製薬会社のアプタマー医薬の開発が進展しなかったことや、「MacugenⓇ」が競争から脱落した事例は、アプタマー医薬の開発(アプタマー創薬)に幾つかの教訓、課題を与えました。
その一つは、創薬ターゲットとする疾患関連タンパク質とそれに対応するアプタマー選択の問題です。
アプタマー創製の技術(SELEX法)に習熟すれば、特定のタンパク質のみに結合するもの、そのサブタイプにも結合するものなど、目的に応じて様々な特性を持つアプタマーの取得が可能となります。
しかし、「MacugenⓇ」の開発において、加齢黄斑変性症は血管内皮増殖因子(VEGF)が関与しているとの知見から、VEGFの様々なサブタイプ(基本的な役割は似ているがタンパク質を構成するアミノ酸に僅かな違いがある)の中から、加齢黄斑変性症の主因と考えたVEGF-165のみを阻害するアプタマー(Pegaptanib)を有効成分として選択しました。世界初のアプタマー医薬として、安全性を考慮したこの選択自体は決して誤ったものではないと当社では考えております。
これに対し、後続の抗体医薬「LucentisⓇ」は、VEGF-165だけでなく他のサブタイプも阻害し、効果の点で、「MacugenⓇ」を上回り、加齢黄斑変性症に対する第一選択薬としての地位を確保しました。
なお、「MacugenⓇ」は、安全性において「LucentisⓇ」を凌ぎ、また、二剤の併用による患者様のQOL※11の向上が期待できることから、現在、併用療法等の臨床試験が行われています。
二つ目は、臨床試験に入る前の開発途上のアプタマーの最適化(改変・改良等)の問題です。核酸を成分とするアプタマーは体内に投与されると生体内の核酸分解酵素により数秒で分解されます。そのため、体内での作用時間を延ばそうとすると、アプタマーに様々な改良を加えて酵素耐性の向上を図り体外への排出を抑制する必要があります。このアプタマーを医薬品として最適な化合物に仕上げる技術を欠くと、たとえ標的分子に結合し、その生理作用を阻害するアプタマーを創製できても、医薬品として開発するのは困難で、結果として開発は進展せず、製品化できなくなります。
これまでに、アルケミックス社を中心として多くのアプタマーが創製、開発されてきましたが、抗体と比較し臨床ステージにある品目が少ないのは、標的としたタンパク質の選定の問題の他に、アプタマーの最適化が不十分であったという事情があるものと当社は考えております。
三つ目は、抗体医薬との差別化をどう図るかということです。後述するように、アプタマーは抗体と比べて優れた点が多々あり、新薬のシーズとして大きな可能性を秘めています。しかし、抗体には標的に結合し、その作用が長時間持続するという、長所とも短所ともなりうる特徴があります。
反面、アプタマーは、最適化を図っても、全身投与で抗体のように1~2ケ月間も作用させることは困難なため、基本的には、急性期、あるいは短期間を挟む間欠投与の適した疾患や症状が、その本領を最も発揮できる対象だといえます。このため、同一のタンパク質を標的とする抗体と競合する場合、抗体が適していない疾患や投与方法をデザインすることが肝要です。
四つ目はCMCです。CMCとはChemistry, Manufacturing and Controlの略語で、医薬品成分の化学的属性や製造管理をいいます。アプタマーは化学合成により製造しますが、抗体ほどではなくとも長大で複雑な構造をした化合物です。しかもRNAという新規の素材を有効成分とするため、品質・規格の設定や製造・品質管理の方法などは、低分子の手法や基準をそのまま適用できません。
このように、アプタマー開発にあたっては、個々のアプタマーごとに個別に品質や規格などを定め、規制当局との協議を通じて新たな基準を構築する必要があるため、CMCに関する十分な知識や経験を必要とします。
(ⅳ) アプタマー医薬の将来性
アプタマー医薬の市場に関しては、現在、臨床試験の後期(PⅢのステージ)段階に入っている製品が複数ありますが、製造販売承認の取得期間などを考慮すると、2015年前後までは眼科領域の加齢黄斑変性症薬「MacugenⓇ」一品の状態が継続するものと思われます。
しかし、今後、現在開発中(特にPⅡ~PⅢのステージ)のアプタマー医薬が世界的に承認され上市されれば、2020年以降には、核酸医薬市場の一定のシェアを獲得できると当社は考えております。
米国 BCC Research社は、全世界のアプタマー医薬の市場が、2012年の13百万ドル(約13億円)から、2017年には17億ドル(約1,700億円)に拡大すると予想しています(参考資料5)。
また、2011年に公表された文献によると、アプタマー医薬は近い将来、医師にとって標準的な手段になると期待されています(参考資料6)。
(ⅴ) アプタマー医薬と抗体医薬の比較
アプタマー医薬は分子標的薬※12として、抗体を成分とする抗体医薬と、作用メカニズム及び投与方法が類似しています。従って、アプタマー医薬の最大の競合品は抗体医薬になります。アプタマー医薬市場の将来性は、抗体医薬との比較のなかで、その違いを明確にし、どう差別化するかにかかっています。
抗体医薬は、マウス等で作製した抗体をヒトで異物として排除されにくいように加工した後、これを産生する特殊な細胞を大量に培養し、精製して医薬品原料にします。その起源が生物試料であることから生物製剤に分類されます。これに対し、アプタマー医薬はその成分であるRNAを化学合成して製造することから合成医薬品に分類されます。
以下は抗体医薬と比較したアプタマー医薬の特徴ですが、アプタマー医薬は、科学技術の進歩とともにその長所が認識され、抗体に続く次世代の新薬の核として開発が進むものと当社は期待しております。
⦅アプタマー医薬と抗体医薬の比較⦆ (当社作成)
[標的タンパク質に対する結合力]
薬効を及ぼす生体内の標的(疾患関連タンパク質など)に対してどの程度強く結合するかを示す指標としては、解離定数(Kd:dissociation constant)という専門的な用語が用いられます。この解離定数は数値が低いほど、結合力が強いことを意味します。平均的な抗体の結合力は、Kd値がnM(ナノモラー、10-9モラー)レベルで、それ以上強い抗体を作ることは容易ではありません。一方、平均的なアプタマーのKd値はnM以下で、pM(ピコモラー、10-12モラー)のアプタマー、つまり抗体の1,000倍強い結合力を持つアプタマーの作製が可能です。
また、強い結合力は、標的タンパク質を速やかに捕捉し、結合したら離れにくいという性質となるため、アプタマーは高い阻害効果を持つと期待されます。
[創薬ターゲットの種類]
抗体は、創薬ターゲット(抗原タンパク質)を動物に投与して作製します。そのため、精製が難しいタンパク質や、ヒトと動物とで違いが少ないタンパク質など、抗原の種類によっては取得が困難、あるいは、不可能なものもあります。一方、アプタマーは、動物は使わずに、試験管の中の操作のみで作製するので、細胞表面に提示された状態の創薬タンパク質を標的として利用したり、ヒトと動物とで違いが少ないタンパク質に対しても創製することが可能であり、創薬ターゲットの種類が非常に多様です。さらに、創薬ターゲットに結合してその作用を阻害するアプタマーだけでなく、将来的には、抗体では難しいとされる受容体に直接作用するアゴニスト・アプタマー(受容体作動薬)、さらに細胞内に他の医薬品を運搬するためのドラッグ・デリバリーシステム(DDS)として利用可能なアプタマー等を創製することが可能です。
[製造]
抗体は製造規模の大小を問わず、現在の科学技術では化学合成による製造はできません。商品化された場合には、通常、大規模な細胞培養設備によって製造します。また、開発段階で数度にわたるスケールアップを要し、それに対応する設備のために多額の資金が必要となります。加えて、製造条件の変更に伴う品質の確認作業(比較試験)も複雑になります。
一方でアプタマーは、商品化後も、比較的小規模な製造設備での化学合成による製造が可能で、しかも、同一の設備を他の核酸医薬品(アプタマーやアンチセンス等)の合成のために使用できます。そのため、アプタマーでは設備投資も製造管理(スケールアップを含む)も容易であるといえます。
[コスト(製造コスト低減の容易さ)]
抗体医薬は細胞培養による生物製剤のため、製造方法が一旦確立すると、細胞培養等の工程を含むために、製造方法の変更や製造コストの低減は容易ではありません。これに対して、アプタマーでは、今後、製造施設や原材料を共用できるアンチセンス、siRNAやmicroRNAなど他の核酸医薬の発展に伴い、核酸医薬全体での製造スケールの拡大が見込まれることから、そうしたスケールメリット、加えて合成機械や合成方法の技術革新による製造コストの低減が期待されます。
[抗原性/免疫排除]
抗体は生物由来のものを成分とする生物製剤のため、ヒトに投与した場合、抗原性を示すことがあり、継続使用において免疫的な排除を受けるリスクがあります。つまり、抗体を排除するための中和抗体が生体内で作られた結果、効果が減弱するということになります。しかし、アプタマーは合成医薬品のため、ヒトで抗原性を示すことはほとんどなく、また、生物製剤でないため、中和抗体ができるというリスクが低くなっています。
[製剤の可逆性・安定性]
抗体の組成はタンパク質であるため、熱等の要因によって、不可逆的な(元に戻らない)変性を受けやすく品質確保には特別な注意が必要です。これに対し、アプタマーの組成はRNAであり、分解酵素のない環境下では安定しています。また熱等によって立体構造が変化しても、その変性は可逆的(元に戻る)で、100℃以下では速やかに元の形に復帰し、活性を回復します。そのため、アプタマー医薬は製剤化や流通、保管が抗体医薬に比べて容易です。
[体内動態(長時間作用)]
抗体は、特別な加工を施さなくても、血中で分解されにくく、分子量が大きいため腎臓からの排泄も受けにくい性質があるため、血中に長く滞留することができます。一方アプタマーでは、未加工の状態では、血中で核酸分解酵素による消化を受けやすく、中サイズの分子量で水との親和性も高いため、腎臓からの排泄を受けやすい性質があります。そのため、アプタマーは、化学的な修飾を施して酵素による消化を防ぎ、ポリエチレングリコール(PEG)のような油性の高分子化合物を結合するなどの加工が必要ですが、逆にこうした加工方法を工夫することで、血中滞留時間を調節できるという利点があります。
[短期作用性]
医薬の中には、長時間体内に滞留することが副作用の原因となる場合がありますが、アプタマーでは、体内での滞留時間が比較的短いという特徴を生かして、短期に作用する医薬の開発が可能であり、さらに加工の方法により、目的と効果に応じた体内動態の医薬を開発することも可能です。
[加工・化学修飾]
抗体は生物製剤であるため、品質や薬効を向上させるための化学的な加工・修飾が容易ではありません。しかし、アプタマーは化学合成によって製造するため、低分子医薬品と同じように様々な化学的な加工・修飾が可能で、品質や薬効の向上のみならず、作用時間の延長や副作用等の回避の手段を講じることができます。
特にアプタマーでは、複数の標的(疾患関連タンパク質)に結合する二種のアプタマーを一つの化合物として合成し、複数の標的に作用する新薬を開発することも、技術的に可能です。
[開発・販売の歴史]
抗体の開発・販売の歴史については(ⅱ)核酸医薬の市場を、アプタマーについては(ⅲ)アプタマー医薬の現状と課題の項をご参照下さい。
[上市実績]
抗体の上市実績については(ⅰ)医薬品市場を、アプタマーについては(ⅲ)アプタマー医薬の現状と課題の項をご参照下さい。
(2)創薬プラットフォーム
① 創薬の戦略とアプタマー
製薬企業が新薬の素材として何を選択するか、という観点からみると、現在の医薬は、大きく以下の4本の柱から成ると当社では認識しております。この中で最も新しく、技術革新が進展しているのが、生物製剤の中の抗体医薬と、核酸を成分とする医薬であると考えております。
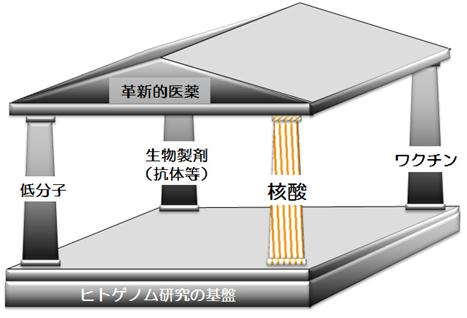
上記の4本の柱の内、低分子を対象とした日本の創薬力は欧米と同等のレベルまで達していますが、抗体やワクチンについては大きく遅れています。
第4の柱である核酸医薬も、日本で初めて創製された、日本発の核酸医薬としてヒトでの臨床試験のステージに入っているものには、NF-κβデコイオリゴとNS-065/NCNP-01(アンチセンス)があります。しかし、既にPⅡやPⅢに入っている多くの開発品を有する欧米と比べて、遅れていることは確かです。
その中で、唯一、アプタマー医薬については、若干の遅れはあっても、大きな差はまだついていません。アプタマー医薬は、前述のように核酸医薬の中核となる可能性を秘めております。
② 新薬開発プロセス
新薬の研究開発は、下記の図に示すように、製品の上市までに、10数年の長い年月と数百億円もの多額の資金を要します。
この新薬の研究開発は、通常、臨床試験前の段階と臨床試験に二分され、さらに臨床試験前の段階は、大きく以下に分けられます。
1)新薬候補と考えられる化合物を考案、創製し、その中から様々な手法を用いて適切な化合物をスクリーニ
ング※13する基礎・探索研究の段階
2)選定された化合物について、臨床試験に進むために必須の試験を行う前臨床試験※14の段階
当社では、新薬開発プロセスの中の(1)基礎・探索研究、及び(2)前臨床試験の段階において、「RiboARTシステム」を運用しアプタマー医薬の開発を行っています。標的タンパク質の種類や特性、適応疾患などによって差は生じるものの、「RiboARTシステム」の活用により、従来なら5~8年かかる基礎・探索研究及び前臨床試験の期間(1年前後のGLP試験※15の期間を含む)の内、標的タンパク質の決定からGLP試験を開始するための予備毒性試験※16ステージまでを、約3~4年で実施可能(当社実績)であると考えております。
⦅新薬開発プロセス⦆
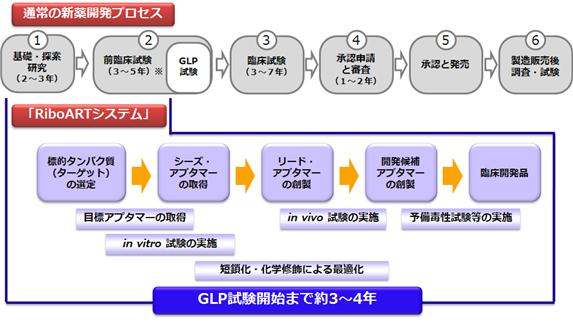 ※:前臨床試験(3~5年)にはGLP試験の期間1年前後が含まれています。
※:前臨床試験(3~5年)にはGLP試験の期間1年前後が含まれています。
③「RiboARTシステム」を用いたアプタマー創薬
当社の「RiboARTシステム」は、シーズ・アプタマー(疾患に関連するタンパク質に結合する候補アプタマー)の取得から最終的な臨床開発品の創出までのプロセスをカバーする、当社独自のアプタマー創薬の技術プラットフォームです。東京大学医科学研究所における研究成果や技術をベースに、当社の研究成果や創意工夫、ノウハウ※17等を含んでいます。
「RiboARTシステム」においてコアとなる技術は、目標とする創薬ターゲット(タンパク質)に結合するポテンシーの高いアプタマーを取得する技術(SELEX法運用技術)と、取得したアプタマーを臨床開発品として最適化する技術です。このコア技術が、意図した薬効を示すポテンシーのアプタマーを取得・創製するうえで大きな効果を発揮します。
本システムでは、取得したアプタマーを新薬候補品となり得るように、加工プロセスによって、標的への結合力を103~104倍に増強し、pM(ピコモラー、10-12モラー)未満のKd値の達成を標準化しており、これが当社の技術的な強みと認識しております。
「RiboARTシステム」の詳細は以下のとおりです。
(ⅰ) アプタマーの取得技術(SELEX法運用技術)
アプタマー創薬のコアとなる技術の一つは、目標とする創薬ターゲット(タンパク質)に結合するアプタマーを取得するSELEX法に関する技術です。この方法は日欧では平成23年6月まで特許で守られ、権利者(アルケミックス社)からライセンスを取得しない限り、SELEX法を実施して自由にアプタマーを取得することはできませんでした。
当社は、この特許が国内で有効であった平成18年10月より、権利者から実施ライセンスを受け、様々なSELEX法を駆使してアプタマーを取得する経験を積んでまいりました。
平成23年6月の日欧での上記特許失効後は、誰でもアプタマーの取得にSELEX法を実施することが可能となりました。しかし、目標とするタンパク質に結合し、意図した薬効を示すポテンシーのあるアプタマーを取得するには、標的タンパク質の特性分析、最適な核酸プールの構築に始まり、様々な条件下でのSELEX法の実施経験やノウハウが必要となります。当社の「RiboARTシステム」はこれらを集大成した創薬技術です。
SELEX法とはRNAの造形力を利用して、目的とするアプタマーを探し出すための技術で、様々なタンパク質を標的に使用できる汎用性が特徴です。具体的には、様々なタイプのRNA分子を標的のタンパク質と何度も結合→解離→増幅→再結合を繰り返すことで、より強く結合するRNA分子のみを“進化”させる技術です。この方法は、以下に示す魚釣りに似ています。
SELEX法を利用したアプタマーの創製(取得)には、最初にプールに放つ魚群の選定(核酸ライブラリーの構築)や釣り方(試験方法等)について、長年の経験・実績によるところが多く、当社はSELEX法に関して、世界でも有数の高度かつ広汎的な技術を有しております。
(ⅱ)アプタマーの最適化技術
アプタマーの最適化技術は、in vitro※18 や in vivo※18試験でのスクリーニングから、より効果が高い(標的タンパク質に強く結合し、そのタンパク質の生理作用を高度に阻害する)アプタマーを創製し、アプタマーの改良技術を駆使して、臨床開発品として完成させるものです。
これには、アプタマーに特化したスクリーニング手法だけでなく、取得したアプタマーの特質と用途に応じた個別の最適化(短鎖化、化学修飾等)技術が必要で、当社の最大の強みは、この分野での豊富な知識と経験並びに技能が蓄積していることであります。
また、的確な最適化には、標的タンパク質の特性(分子量、立体構造、電気化学的性質、類縁タンパク質(サブタイプ)の有無等)に応じた最適化のデザイン力が必須です。当社には、このデザインに関しても研究実績を蓄積してまいりました。
を、in vitro や in vivo 試験で効果を確認しつつ繰り返し、より優れた臨床開発品へとアプタマーを磨き上げていきます。
(ⅲ) アプタマーの製造法、品質規格の設定、品質管理等のノウハウ
・アプタマーを医薬品化するために不可欠な製造方法、品質規格の設定、品質管理
・アプタマーの血中での濃度測定
・核酸やアプタマーのような高分子化合物の分析、核酸の塩基配列の解析法
④ その他の創薬体制
当社はさらに、アプタマー医薬の開発のために、以下の体制を整えております。
(ⅰ) アカデミアでの研究成果の取り込みと連携及び共同研究
当社は、発足の経緯から、東京大学医科学研究所で培ってきたRNA科学やアプタマーに関する成果を実用化するため、トランスレーショナル・リサーチ※19を継続的に実施してきました。
東京大学との共同研究は現在も継続し、同医科学研究所・クレストホール内にも自社の研究室を設置して、同研究所内の動物試験施設やRI(ラジオアイソトープ)試験設備、その他の高度試験装置を使用できる恵まれた環境を維持してきました。これにより技術、信頼性の観点から、高レベルの研究体制を整備しております。
当社は、東京大学以外のアカデミアとも共同研究を実施し、疾患に関連するタンパク質の学術的な裏付けを得ると当時に、各種動物試験の実施、アプタマーの分析等における連携を図っております。
(ⅱ) 的確な研究開発マネジメント
当社では、新薬開発ステージに応じた試験研究の内容、当該試験結果のクライテリアの設定、知的財産戦略等について、新薬開発のノウハウを熟知したスタッフによる定期的なレビューなどの研究開発マネジメントを実施しております。
(ⅲ) 人的ネットワーク
アプタマーを含む核酸医薬の研究開発は日進月歩の状況にあり、世界的に競争が加速しています。当社は核酸科学やアプタマーに関する研究者・研究機関との、世界的規模の人的ネットワークを通じて、最新の研究動向の把握に努めております。
(ⅳ) アプタマー創製のスペシャリスト
当社では、役職員の3/4が、化学、細胞・生物、工学、医学等の分野での専門家(研究員)であり、研究員の約半数は博士号の保持者です。これらの研究員は、アプタマー医薬に特化した研究開発に従事しており、この分野では強力な布陣をしいております。
さらに、大手製薬企業で研究開発や知財・ライセンス事業の経験を長く積んだ社員も擁しており、臨床開発やライセンスに連なる基礎・探索研究の方向づけや知財戦略を展開しております。
(3)創薬事業
①当社のビジネスモデルについて
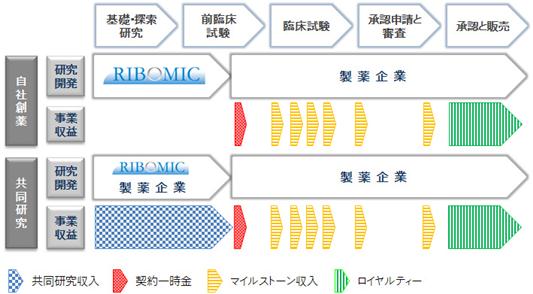
当社の創薬事業は、(ⅰ)自社創薬及び(ⅱ)他の製薬企業との共同研究という二つから構成されています。
自社創薬とは、一定の開発段階まで自社独自で医薬候補となるアプタマーを開発し、その後、その成果を製薬企業にライセンス・アウトし、契約締結時に受け取る契約一時金、開発進行に伴うマイルストーン収入、及び製品上市後の売り上げに応じたロイヤルティーを得る事業です。
これに対し、共同研究とは、アプタマー医薬の研究を提携製薬企業と共同で行い、当社が分担する業務に応じて提携先から支払われる研究費を収入として得る事業です。さらに共同研究では、アドバイザリー契約を除いて、一定の開発段階に達した時点で提携先の製薬企業に当社分の権利をライセンス・アウトし、相応の契約一時金やマイルストーン収入等を得てまいります。
自社創薬によるライセンス・アウトに依存しすぎると、ライセンスの成否やその成約の遅れ等により事業計画が大きく影響を受けます。他方、共同研究は安定的な共同研究収入を一定期間期待できます。
従って、自社創薬に共同研究の特徴をうまく組み合わせることで、以下の成果あるいは効果が期待できます。
1) 自社創薬のビジネスモデルに伴う収益の不安定化というリスクを低減できる。
2) 共同研究先の新薬開発のノウハウ、経験を知得できる。
3) 共同研究が順調に進む場合、ライセンス・アウトの実現可能性が高い。
4) 事業を全体として拡大できる。
⦅自社創薬及び共同研究における一般的な収益計上のタイミング⦆
 注:上記の図は、一般的なケースとして当社が想定している収益計上のタイミングを表すものです。
注:上記の図は、一般的なケースとして当社が想定している収益計上のタイミングを表すものです。
個別の契約によりそれぞれの金額や受取回数等が異なる場合があります。
(ⅰ)自社創薬について
新薬の開発において、基礎・探索研究、前臨床試験、臨床試験へと開発のステージが進捗するに従い、その経費は大幅に増加します。
また、臨床試験ステージになると、自社で開発を推進する場合には臨床試験用の社内体制を備える必要が生じ、さらにPOC※20確認後の臨床試験では、適応症にもよりますが、被験者数が飛躍的に増え、費用が莫大になります。上市後のマーケティング戦略を視野に入れた対応も必要となります。従って、POC確認後の臨床開発は、資金、経験やノウハウを有する製薬企業にて実施することが、アプタマー医薬の成功確率を高め、かつ早期の上市につながると考えております。
これらの事情に鑑みて、当社としては、自社での研究開発の将来目標はヒトでの薬効が確認された時点(POC確認時点)としております。ただし、早期事業化の品目として選定したテーマである場合や、ライセンス先の製薬企業との間で合意が成立した場合は、それ以前であってもライセンス・アウトを実施いたします。
なお、ライセンス・アウト後は、当該品目の開発や製造、販売などはライセンス先がその責任で行うことになります。しかし、当社のアプタマー医薬に関する知見が必要な場合、一定期間、共同研究を行うことがあります。
(ⅱ)共同研究について
共同研究は、製薬企業(提携先)とともにアプタマー創薬を実現することを目指す共同研究契約と、アプタマー創薬を行っている製薬企業に対するアドバイザリー契約があります。具体的には、共同研究契約では、創薬のターゲットとなる疾患関連タンパク質は提携先の領域戦略などに従って選択され、当社はかかるタンパク質の生理作用を阻害・抑制し、提携先が求める基準を満たすアプタマーを創製いたします。提携先はそのアプタマーについて薬効等の確認・評価(スクリーニング)、安全性試験等を行い、早期に臨床試験の対象となる臨床開発品を特定し、以降は提携先のイニシアティブで臨床開発を推進します。アドバイザリー契約では、アプタマー創薬を行っている製薬企業に対し、アプタマー医薬開発に関する試験研究の受託、技術指導を行っております。
共同研究では、製薬企業との間で作業分担を定めますが、当社が分担するアプタマーの創製に関する研究活動に対しては、適切な対価を得ることとしております。この役割分担に関しては、双方の有する技術や知識、経験をベースとして協議により決定しますが、当社の主な役割はアプタマーの創製やその改良となります。なお、当社では、共同研究の対価として受取る収入は共同研究収入として事業収益に計上し、試薬等の実費補填として受取る収入は受取研究開発費として営業外収益に計上しております。
また、共同研究では、当社のアプタマー医薬の開発に関する知識や経験を深めることが可能となり、さらに、アドバイザリー契約を除いて、一定の開発段階に至った場合、共同研究先へライセンス・アウトすることを前提としているため、ライセンス・アウト実現の可能性が高く、ライセンス先を探す必要もほとんどありません。
現在、当社が推進しているアプタマー創薬に関する共同研究は以下のとおりであります。
②パイプラインについて
創薬事業(自社創薬及び共同研究)のパイプラインのうち、基礎・探索研究段階を終え前臨床試験に進んでいるプロジェクトは下記のとおりです。
〈各パイプラインの進捗⦆
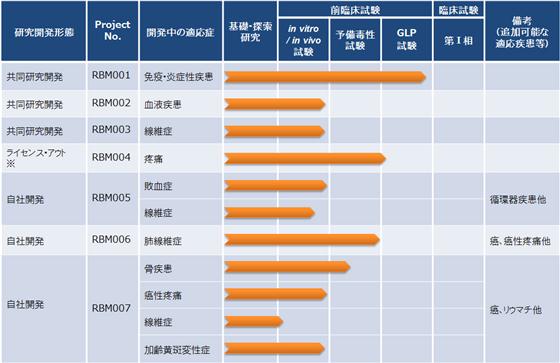 ※:平成26年4月に藤本製薬株式会社にライセンス・アウトいたしました。
※:平成26年4月に藤本製薬株式会社にライセンス・アウトいたしました。
(ⅰ)自社創薬パイプライン
自社創薬の疾患領域と当該疾患領域における主要なパイプラインの概要は以下のとおりです。
a) 疼痛領域(RBM004:抗NGFアプタマー)
痛みは体の異常を伝える重要なシグナルですが、時にQOLの質を損ない、様々な生活上の支障をもたらします。このため、多くの鎮痛薬が開発され市販されてきました。
2012年度の日米欧の鎮痛剤の市場は1兆8,523億円で、米国市場が59.3%のシェアを持っています。その中で最も大きな市場を占めるのが強力な鎮痛作用を持つモルヒネなどのオピオイド(医療麻薬)製剤で、7,368億円の市場を構成しています。
(参考資料8)
オピオイド製剤にはモルヒネやオキシコドンなど様々な種類があり、また、多くの新製品が開発されています。何れの製品も即効性で効果が強い反面、耽溺性や嘔吐等の副作用があり、長期間の持続的な鎮痛に用いることは難しく、また、その乱用を防止するために保管、流通、使用が厳しく規制されています。
市場には多くの鎮痛剤がありますが、オピオイドと同程度の鎮痛効果があり、長期間(1~2週間)その作用が持続し、かつ依存性や耽溺性がなく、中小病院や診療所でも安心して使用できる製品は無く、鎮痛剤の市場にも未だにUnmet Medical Needsの領域が残っています。
または併用によってQOLを高めるアプタマー医薬の開発を進めております。
さらに、この分野だけでなく、手術後や痛風、リウマチの急性期での疼痛など数日続く重度の痛みに対し、単回での投与でその痛みが寛解する医薬品にも大きな需要が見込まれます。
この鎮痛剤市場のUnmet Medical Needsを充たす新薬の創薬ターゲットとして当社が狙っているのがNGF(Nerve Growth Factor、「神経成長因子」)であります。
NGFは世界で最初に発見された成長因子で、末梢における疼痛の原因物質として知られています。従って、生体内でのNGFの作用を抑えれば、様々な痛みに対する効果が期待されることから、ファイザー等の世界的な製薬企業が抗NGF抗体を疼痛治療薬として開発しています。
⦅NGFによる痛みの伝達⦆
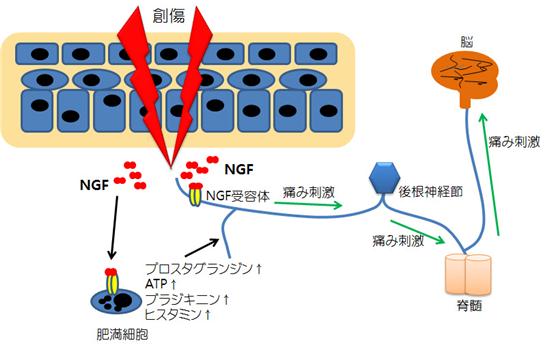
当社が研究開発中の抗NGFアプタマーは、いずれも抗NGF抗体と同様にNGFの生理作用を阻害し、抗体医薬には無い「1回の投与で2日~7日間(最大2週間)作用が持続する」という優れた特性を示しております。
このアプタマーは、抗体と異なり、作用時間が長すぎないため、医師のコントロールで安全性を確保できますし、さらに、病態モデル動物※21を用いた試験で、オピオイドを代表するモルヒネや抗NGF抗体と同程度の鎮痛効果を示しています。
当社はこれらの特性を活かし、抗体医薬では適さない、術後痛や痛風痛等の短期間での中等度から激しい疼痛に対する第一選択薬、さらには癌性疼痛や関節炎痛等に対する安全性の高い革新的な治療薬となることを狙っております。
抗NGFアプタマーについては、術後痛や癌性疼痛についての病態モデル動物での薬効確認がとれ、ヒトでの臨床試験の対象となる開発候補アプタマーの選定も終えています。また、開発候補アプタマーを用いたラット及びサルでの予備毒性試験も完了しています。
なお、抗NGFアプタマーを含む本プロジェクトに関しては、平成23年までに3件の物質特許が出願済みであり、その内、開発候補アプタマーとして選定したアプタマーをカバーする物質特許出願に関して、平成24年6月に、日本で特許(特許第5027956号)が成立いたしました。欧米その他の国でも本件特許の成立を見込んでおります。なお、本プロジェクトに関する特許の詳細については、後述の(5)知財戦略③主要な特許の状況の項を参照下さい。
平成26年4月、本プロジェクトについて藤本製薬株式会社との間で全世界を対象とした独占的ライセンス契約を締結いたしました。POCを確認するまでは当社も積極的に開発をサポートして新薬の実現に貢献すると同時に、臨床開発に関する経験や知識の蓄積に役立てる予定です。
抗NGFアプタマーは、主たる目標を鎮痛剤として開発してきた製品であります。後述の自社開発品の標的であるATXやFGF2も疼痛の起因に関与する可能性が学術文献で指摘されており、当社で行ったマウスを用いた癌性疼痛モデルにおいて、抗FGF2アプタマーがモルヒネと同等の鎮痛効果を持つことを確認しております。
これらのプロジェクトを合わせて、当社は疼痛分野における新規創薬ターゲットにおいて、可能性を秘めた複数の開発物質(アプタマー)を有しております。
b) 敗血症領域(RBM005:抗HMGB1アプタマー)
敗血症は細菌、ウイルス、菌類による感染がもたらす最も重篤な疾患で、病原菌に対する体の炎症反応が制御不能になり、体の免疫システムそのものが組織や臓器に損傷を与え、多臓器不全、ショックにより高い確率で死をもたらします。
世界的な敗血症の撲滅運動を展開しているGlobal Sepsis Alliance(世界敗血症連盟)の調べでは、毎年、敗血症患者は2,500万人に上り、その内、800万人が死亡しています。
なお、先進医療国である米国でも、毎年75万人が罹患しているとの報告があります(参考資料9)。
敗血症の治療には、抗生物質を始めとする様々な薬剤が使用されていますが、多臓器不全やショックに対する決定的な治療薬はありません。これまで、全世界の製薬企業が敗血症の治療薬の開発を進めてきましたが、市販後に有効性の問題で販売中止や、臨床試験(PⅢ)で所期の成績を得られないなど、開発に成功しているとはいえません。
この敗血症領域におけるUnmet Medical Needsを充たすべく、当社が狙っている創薬ターゲットはHMGB1(High Mobility Group Box 1)であります。敗血症患者の血液中でHMGB1は検出され、特に死亡例では、生存例、健常人に比較し高値を示すため、HMGB1は敗血症ショックを引き起こす主要な因子と考えられています。
HMGB1は細胞の核内のDNAに結合しているタンパク質で、転写(DNAを鋳型にしてRNAを合成すること)に重要な役割を果たしています。しかし、何らかの原因でこれが細胞外に放出されると、糖化タンパク質の受容体(RAGE)と結合して炎症性サイトカインの産生を誘導します。
炎症性サイトカインとは、体内に異物が侵入したときに産生され、生体防御に関与する多種類の細胞に働きかけるタンパク質です。この炎症性サイトカインが何らかの原因で体内に過剰に放出されると、様々な炎症性疾患を引き起こします。
本プロジェクトは、このHMGB1の生理作用を阻害するアプタマーを創製し、敗血症の治療薬として開発するものであります。in vitro 及び病態モデル動物での試験を終えたアプタマーについて、NEDOからの助成資金(平成23年8月~平成26年2月)をベースとして積極的に開発を行い、開発候補アプタマーの創製に到達いたしました。
なお、HMGB1は線維症の発症に関与する可能性もあることから、当社の線維症プロジェクトの1テーマとしても研究を進めております。
c) 肺線維症等の線維症領域(RBM006:抗ATXアプタマー、RBM005、RBM007 他)
体の器官や臓器が線維化して本来の機能を発揮しなくなる疾患に線維症があります。線維症は、肺、肝臓、腎臓、筋肉等に起きますが、当社が最優先に狙っているのは、難治性で癌に移行する可能性が高く、治療満足度の低い重篤な疾患である特発性肺線維症(Idiopathic Pulmonary Fibrosis, IPF)であります。
IPF患者数は、国内での疫学調査では約1.5万人と推定されていますが(参考資料10)、米国での調査(2006年)では、10万人当たり14~42.7人、欧州での調査(2012年)では10万人当たり26人であったと報告されています(参考資料11)。
IPFの治療薬として、従来は抗炎症作用のステロイドや抗凝固剤などが用いられてきましたが、2008年、世界初のIPF治療薬として、抗線維化作用を有するピルフェニドンを成分とする「ピレスパⓇ」が国内で販売されました。
しかし、「ピレスパⓇ」には高い頻度で光線過敏症が認められ(臨床試験において被験者の半数以上)、日常生活での活動が制限されるほか、その効果も限定的です。
従って、現在、IPFに対する治療はその進行の阻止や症状の緩和に限定され、満足度の高い治療薬は世界的に見てもありません。
このようなIPF におけるUnmet Medical Needsを充たすべく、多くの製薬会社が様々な薬剤を開発しています。Global Data社が2013年4月に出した市場調査報告では、米国、フランス、ドイツ、イタリア、スペイン及びイギリスでのIPF治療剤の市場は、2012年の49百万ドルが、2017年には1,100百万ドルになると予測しています(参考資料12)。
当社はIPF だけでなく腎臓や肝臓等の組織における線維症の治療というUnmet Medical Needsを充たすべく、線維症の発症やその進行に関連する以下のタンパク質を創薬ターゲットとして検討し、研究してまいりました。何れも低分子や抗体で十分な成果を上げていないもの、あるいは臨床ステージに入っている他社開発品のないものであります。
上記、線維症の創薬ターゲットの中の重点品目はATX(Autotaxin)であります。
ATXは悪性癌細胞から分泌され、自身の細胞運動性を促進する因子として発見されたタンパク質で、その後、癌細胞以外からの分泌も確認されました。ATXの発現亢進は乳癌、脳腫瘍などの癌、動脈硬化、肺線維症、神経因性疼痛などの疾患に関連するとされ、特許出願を調査したところによると、世界中の企業や大学の研究者がATXの阻害剤を癌や線維症などの治療剤として研究開発しています。しかし、現在に至るまで、抗体を含め有望なATXの阻害剤は得られていません。
当社は、各種肺疾患患者の血清中及び肺胞洗浄液中のATX濃度についての論文報告や、ATXが間質性肺炎・肺線維化を促進するメカニズムについての研究等を精査した結果、ATX阻害のアプタマーが臓器線維症、特に肺線維症に対する有力な治療剤となる可能性を見出しました。そこで、肺線維症をターゲットとして、ATXの生理作用を阻害するリード・アプタマーを創製、最適化し、in vitro 試験及び病態モデル動物(肺線維症動物モデル)での試験で効果を確認いたしました。
このアプタマーについては、NEDOからの助成資金(平成23年8月~平成26年2月)をベースとして積極的に開発を行い、開発候補アプタマーを創製いたしました。現在、臨床試験に入る直前のステージ(GLP試験)に必要なデータを得るため、動物での予備毒性試験を実施し、データ、資料を蓄積しつつあります。また、投与ルートの検討に関連する試験を実施中であります。
線維症は複数の因子が異なるステージで関与する複雑な疾患であると考えられることから、当社では上記のATX、FGF2、HMGB1、TGF-βに、平成26年4月よりさらに探索段階の複数の創薬ターゲットを加え、多角的な視点から線維症プロジェクトに取り組んでおります。
今後、開発の進んでいるテーマ(抗ATXアプタマー及び抗FGF2アプタマー)については、臨床試験に移行するための各種データの獲得に向けた研究を進め、同時に、製薬企業との共同研究あるいはライセンス・アウトのための予備的折衝を開始しております。
d)骨疾患領域(RBM007:抗FGF2アプタマー)
骨疾患領域には、リウマチの進展による関節破壊、癌の骨転移など、十分な治療効果が得られず、また予防できないUnmet Medical Needsが残っています。
関節リウマチの治療については、2000年代に入りTNF-α※23を対象とした抗体医薬が出現し、その進行の阻止や改善に画期的な効果を示し、2012年には全世界で1兆5,000億円を超す巨大な市場になっています。
なお、株式会社富士経済が2012年6~8月に行った調査では、日本での関節リウマチ治療薬トータルの市場は、2011年に1,663億円だったものが2020年には2,370億円に増えると予想されています(参考資料13)。
しかし、抗体でも奏功しない患者が存在することや、破壊された軟骨の修復・復活という面では、抗TNF-α抗体も十分な成果を上げておらず、予防できない分野が残っています。
また、リウマチ患者が骨そしょう症を併発することはよく知られており、リウマチに伴う関節破壊と骨そしょう症を共に防止する薬剤は、Unmet Medical Needsの製品として、大きな可能性があります。
さらに、大きな苦痛と致命的な効果をもたらす癌の骨移転の防止や癌化した骨の正常骨への回復、また骨転移に伴う症状(特に激しい痛み)の緩和に対する薬剤は開発されつつありますが、十分といえる状況ではありません。
当社が上記のような、関節リウマチに伴う関節破壊の防止や改善、さらに骨そしょう症の治療から癌の骨転移の治療とその症状(特に激しい痛み)の緩和という目的で開発しているテーマが抗FGF2アプタマーです。
FGF2(Fibroblast Growth Factor Ⅱ、「線維芽細胞増殖因子2」)は血管の新生因子として広く知られており、その阻害剤(特に抗体)は、主に抗癌剤として内外の製薬企業によって研究されています。しかし、FGF2に特異的に結合し、意図する薬効が得られる抗体医薬の創製は極めて困難なため、未だに十分な成果はあがっていません。
本プロジェクトはこのFGF2の生理作用を阻害するアプタマーを開発するもので、東京大学医科学研究所との共同研究テーマとして推進してきたものです。
当社が開発中の抗FGF2アプタマーの特筆すべき特徴は、骨疾患に対する根本的な治療薬を提供でき、同時に骨疾患における疼痛に対してモルヒネと同等な鎮痛作用を期待できることです。さらに、血管新生を抑制する作用があるため、「MacugenⓇ」とは異なる機序に基づく加齢黄斑変性症に対する治療薬の開発が期待できます。また線維症への用途拡大も見込まれます。
現在、臨床試験に移行するための各種データの獲得に向けた研究を進め、同時に、大手製薬企業との間でライセンス・アウトのための予備的交渉を行っております。
(ⅱ)共同研究パイプライン
共同研究パイプラインの概要は以下のとおりです。
(A)大塚製薬株式会社との提携
a)RBM001
平成22年6月10日締結の共同研究契約に基づき、ミッドカインを創薬ターゲットとし、免疫・炎症性疾患などを対象とするプロジェクトです。これまで複数のテーマ(対象疾患)について研究を行ってきましたが、現在、適応疾患の再検討を行っております。
b)RBM002
平成20年1月1日締結の複数のターゲットを対象とした共同研究契約に基づくプロジェクトの一つで、循環器領域を対象としたものです。現在は血液疾患を対象としたテーマについて、前臨床試験を実施しております。
c)RBM003
上記の平成20年1月1日締結の共同研究契約に基づくプロジェクトの一つで、線維症を対象疾患としたものです。
(B)大正製薬株式会社との提携
同社が選択したアプタマー創薬テーマについて、3年間の共同研究を平成26年3月より開始しております。
③ ライセンス・アウト済みプロジェクト
当社の創薬事業のプロジェクトのうちライセンス・アウト済みのプロジェクトは、以下のとおりであります。
当社は平成26年4月、NGFに対するRNAアプタマーを含有する医薬品の開発、製造、販売に関して、全世界での独占的実施権を許諾するライセンス契約を藤本製薬株式会社と締結しております。
当社は、当該契約の締結に伴う契約一時金を受領しており、今後は開発の進捗等に応じたマイルストーン収入、及び売り上げに応じたロイヤルティーの受領を計画しております。
④ その他
当社は、創薬以外へのアプタマーの応用も行っております。
その一つに、IgGアプタマーがあります。IgGはヒト血清中に最も多く存在(70~75%)する免疫グロブリンで、抗体医薬として実用化されています。
当社は、アプタマー創薬に関する技術開発の過程において、IgGの特定の部分(定常部)に結合するアプタマーを取得し、このアプタマーの機能解析を進めた結果、抗体医薬の分離精製に利用できることを証明いたしました。
本アプタマーに関する特許は平成24年1月に日本において成立(特許第4910195号)し、現在、その商品化のため、大手化学品商社を窓口として製薬企業との協議を行っております。
上記の他に、アプタマーを利用した次世代の基盤技術の開発も進めております。その一つとして、iPS細胞(人工多能性幹細胞)の創製や維持、あるいは分化誘導に関する制御性アプタマーの研究を開始しております。
本研究は、当社の基盤技術である「RiboARTシステム」の新たな応用を目指すものであります。
(4)アライアンスの推進
① ライセンス戦略
当社は、様々な疾患領域のアプタマー医薬を開発できるという基盤技術を最大限に生かすため、一般的な創薬系バイオベンチャーに比べて、比較的早期の研究開発段階(前臨床試験段階からPOCの確認前後段階)においてライセンス・アウトを行うことを基本としております。
当社は東京大学医科学研究所の研究成果を事業化するために発足した大学発のベンチャー企業であったことや、研究実施のために公的資金の提供を受けたプロジェクトも複数例あることから、その成果については、できる限り国内企業へライセンス・アウトすることを意図し、アプローチしてまいりました。
また、当社はこれまで共同研究やライセンス・アウトに連動して、複数の共同研究先及びライセンス先と資本提携も実施し、より強固で統合的な事業推進を図ってまいりました。
今後は、アプタマー創薬に取り組む企業の拡大が見込まれ、それに伴う事業チャンスを活かすために営業活動の地域を海外にも広げ、共同研究やライセンス・アウトの機会の拡大を図ってまいります。
② アライアンスの推進体制
当社におけるアライアンス活動(共同研究やライセンス・アウトの実現)の主管は知財・調査企画部です。
自社創薬品目のライセンス・アウト実現のためには、可能性の高い提携候補先の選定、候補先での導入決定を促す試験成績・データ(製品差別化のポイント、製品売上高の予測、競合品に対する優位性等)の創出、交渉の進展に応じたタイムリーな情報提供、さらには事業化や開発に関する的確な提案、粘り強い交渉などが必要です。
また製薬企業側のニーズの把握と積極的なアプローチも必要です。
これらの活動を行うためには、医薬品業界におけるライセンスや事業開発の経験や、国の内外の製薬企業と広汎なネットワークを有する人材が不可欠です。
このため、当社では医薬品業界での新薬の開発経験と実績のある人材を配置し、知財・調査企画部に医薬品業界の法務・ライセンス部門での豊富な経験を持つ者を擁し、また研究開発や知財に関する社外専門家も活用できる体制を構築しており、アライアンスの実現に向けた体制を整えております。
③ 産学連携、トランスレーショナル・リサーチの推進
当社のコアな技術である「RiboARTシステム」を構築する主要な知識、技術は、東京大学医科学研究所との提携によりもたらされたものであります。
現在においても東京大学や東北大学薬学部、名古屋大学医学部等との緊密な連携を図り、アカデミアでの研究成果を事業化するための開発に移行させ(トランスレーショナル・リサーチ)、その実用化を目指しております。
特に東京大学医科学研究所とは平成17年6月より共同研究による提携を開始し、平成24年4月以降は社会連携講座(「RNA医科学」社会連携研究部門)の下での連携を図っております。
(5)知財戦略
創薬プラットフォーム系バイオベンチャーである当社にとって、開発する製品が特許により保護されていることが、他社とのライセンスや共同研究を実現する上で不可欠です。
当社の知財戦略は、開発する製品に関するものと、開発技術に関するものとに峻別し、以下のような異なる対応をしております。
① 自社創薬品目及び共同研究品目に対する知財戦略
物質特許の取得を必須としております。なお、RNAを成分とするアプタマーは配列の違いによって、同一標的分子(疾患関連タンパク質)について権利範囲の抵触しない複数の物質特許が成立する可能性があります。
このため、標的分子との結合力が強く、かつ、その生理作用に対する阻害活性の高いアプタマーだけでなく、その周辺の化合物も特許でカバーし、さらに、無数にある核酸配列の中から結合力及び阻害活性の高いアプタマーに共通する配列を探索し、その共通配列を特許化することで、広い権利を押えることを基本戦略としています。
また、共同研究品目については、提携先との共同出願となるのが通例ですが、ライセンス・アウトに伴い、開発や事業化についての独占実施権を提携先に付与しても、当該特許に対する自社権利は維持する(共有とする)方針を堅持いたします。
なお、特許の出願国については、日米欧を中心として、中国、韓国、インド、ブラジル等の医薬品市場の規模が大きく、または将来の市場拡大が見込まれる国や地域をカバーすることを狙っております。
②「RiboARTシステム」に対する知財戦略
「RiboARTシステム」のコアとなる技術(アプタマーの取得、短鎖化や化学修飾等の最適化)に関するものの中には、特許化して権利の独占を図れる可能性のある技術も含まれているものと当社は考えておりますが、特許化にはその技術を公開するという代償を伴います。
アプタマーは、その質さえ問わなければ、日欧で既に特許期間が失効したSELEX法を含む公知の方法で取得可能です。そのため、当社の特許化された技術を使用して他社がアプタマーを取得したとしても、それが当社の特許技術を使用したことを立証することは困難で、特許出願に伴う技術の公開は、敵に塩を送るに等しいものです。
従って、当社では、原則として「RiboARTシステム」により創製されたアプタマー医薬品候補物については、特許を取得する方針でありますが、「RiboARTシステム」を構築する技術自体は、特許化による競争優位性が確保されるものを除きノウハウあるいは「営業秘密※17」として秘匿し、優位性の確保に努めます。なお、当社はノウハウあるいは営業秘密が社外に流出しないよう、役職員や取引先との間で秘密保持義務等を定めた契約を締結し、厳重な情報管理に努めております。
③主要な特許の状況
自社創薬品目としてライセンス・アウトしたRBM004(抗NGFアプタマー)をはじめとする、当社の研究開発に関する主要な特許の状況は以下のとおりであります。
⦅自社創薬品目に関する主要な特許⦆
⦅共同研究品目に関する主要な特許⦆
⦅参考資料⦆
⦅用語解説⦆
「RiboARTシステム」は様々なアプタマー医薬の開発に応用できるものですが、当社は、特に「Unmet Medical Needs」疾患領域に的を絞り、医療機関や患者様から求められている新薬の提供を目指しております。
アプタマーとは核酸であるRNA※1を素材とした分子で、多様な立体構造を形成できるというRNAの特性を利用して、病気の要因となるタンパク質に結合してその働きを阻害あるいは調節します。その名称については、標的にフィットするという意味のラテン語の「aptus」が由来となり「アプタマー」と呼ばれております。
当社は、RNAの生化学的性質の把握、特に潜在的なRNAの造形力※2の掘り起こし、アプタマーの構想・デザイン、アプタマーの創製から医薬候補アプタマーの仕上げまでをカバーする「RiboARTシステム」をアプタマー創薬の基盤技術として確立しております。この「RiboARTシステム」は、様々な疾患分野や創薬ターゲットに対して応用可能な汎用性を有する創薬基盤技術です。自社で特定の新薬開発を行うのみならず、他の製薬会社の要請に応じて新薬のシーズ(タネ)を供与できるバイオベンチャーであることから、当社自身のことを「創薬プラットフォーム系バイオベンチャー」であると定義しております。
「RiboARTシステム」の概念図は以下のとおりです。
⦅RiboARTシステムの概念図⦆

| 選抜: | 目標とする標的タンパク質に結合するアプタマーをSELEX法により選抜 |
| 分析: | 選抜したアプタマーの標的タンパク質への結合特性を分析 |
| 加工: | アプタマーを工業的、経済的に利用できるよう短鎖化したり、品質や薬効向上のために化学修飾※3を実施 |
| 試験: | 細胞試験や動物試験によりアプタマーの薬理効果を評価 |
| 評価: | 動物を用いてアプタマーの毒性を評価 |
このような「RiboARTシステム」をベースとして、当社は、早期ライセンス・アウト※4を前提とした「自社創薬」と、製薬会社との「共同研究」の二つをバランス良く組合せて実行することを、事業展開の基本方針としております。
当社の事業の系統図は以下のとおりです。
⦅事業の系統図⦆

※:ライセンス対価には、当社が製薬企業より受け取る①契約締結時の一時金、②開発の進捗に応じたマイルストーン収入※5、③製品発売後の売上に対するロイヤルティーがあります。
創薬事業における共同研究では、アドバイザリー契約の下、アプタマー医薬開発に関する試験研究の受託、技術指導も実施しております。
また、当社は、上記の創薬事業に付随する事業として、医薬品以外への応用可能性を秘めたアプタマーの実用化検討も行っており、その一環として、抗体※6であるIgGに特異的に結合する性質を有したアプタマーを、工業用資材(抗体医薬※6の精製剤等)として開発することを目的に、大手化学品商社を窓口として製薬企業との協議を行っております。
(1)アプタマー医薬
| ①アプタマー医薬について 核酸であるRNAは、生物の体内では、DNA上の遺伝情報の配列のコピーとして、タンパク質の合成の鋳型として使用されます。しかしRNAは、そうした遺伝情報のコピーとしての役割だけではなく、「様々な立体構造を形成する」という重要な特性を有しています。この造形力を利用して、標的とするタンパク質に結合してその働きを阻害あるいは調節できるRNA分子(アプタマー)を創製し、医薬品として開発したものが「アプタマー医薬」です。 アプタマーの特徴は、右図に例示するように、標的とするタンパク質の形状にフィットする立体構造を形成してその活性を調節する「形状捕捉」です。抗体医薬がタンパク質を構成する多数のアミノ酸の中から6~10個のアミノ酸の配列(エピトープと呼ばれる)を認識して標的タンパク質に結合するのに対して、アプタマーの標的タンパク質を捉える方法は大きく異なるといえます。 アプタマー医薬は核酸を成分とすることから核酸医薬※7の一種になり | ⦅形状捕捉図⦆ |
ます。しかし、細胞内に入らなければ効果を発揮しない他の核酸医薬とは異なり、細胞内に導入する必要がないので非常に効率的です。アプタマー医薬としてこれまでに上市された製品は、2004年12月に米国食品医薬品局(FDA)が承認した「MacugenⓇ」(加齢黄斑変性症※8に対する治療薬)のみで、アプタマー医薬の市場は未開拓の領域といえます。
②医薬品市場におけるアプタマー医薬
(i)医薬品市場
IMS Health 社等の調査では、2012年の世界医薬品市場は約9,621億ドルで、2015年には1兆810億ドル、2020年には1兆3,180億ドルになると予想されています(参考資料1,2)。
着実に成長する医薬品市場の中で、現在の新薬開発の大きなトレンドは抗体医薬です。抗体医薬は30年を超える開発の歴史を有し、国立医薬品食品衛生研究所の調べでは、現在、日米欧で40を超える品目が承認され販売されています。
2003年の抗体医薬の売上高は52億ドルでしたが、2011年には421億ドルに拡大し、2015年には560億ドルになると予想されています (参考資料3)。
抗体医薬の開発に立ち遅れた日本の大手製薬企業は、2007年以降、欧米の抗体医薬開発ベンチャーを買収するなどの手段により、この市場に参入を始めました。現在、全世界で数百件の抗体医薬の臨床試験※9が進行しており、さらに市場規模が拡大すると当社は考えております。
しかし、抗体医薬は開発・製造コストが高く、医療費を圧迫する要因であると指摘され、抗体医薬に続く次世代新薬として核酸医薬が期待されています。
(ⅱ) 核酸医薬の市場
核酸を成分とする医薬品は「核酸医薬」と呼ばれ、新規な創薬技術として、低分子、ワクチン、生物製剤(特に抗体)に続く第4の柱となりつつあります。核酸医薬の中で最も早く開発が進んだのはアンチセンスです。
アンチセンスは1980年代の後半から世界的な開発ブームが起き、欧米のバイオベンチャーを主体として様々なアンチセンス薬が開発されてきました。しかし、開発に成功したのは1998年8月に米国FDAの承認を得たサイトメガロウイルスによる網膜症を適用疾患とするISIS社の「VitraveneⓇ」のみでした。
アンチセンスは細胞の中で作用するため、細胞内にアンチセンス薬を運ぶ仕組み、方法(ドラッグ・デリバリー・システム(DDS))がないと効果を発揮できません。このDDSの困難さがアンチセンスの開発を大きく阻害してきました。因みに、「VitraveneⓇ」は眼球内投与の薬剤です。
2013年1月、約15年の歳月を経て二番目のアンチセンス薬として、家族性高脂血症薬の「KynamroⓇ」が米国FDAで承認され、全身投与(静注や筋注、皮下注など全身への薬剤の移行を伴う投薬方法)の核酸医薬が初めて実現しました。
世界で最初に承認された抗体医薬は、腎移植後の急性拒絶反応を適応症とするマウス抗体であり、1986年に承認されました。二番目の抗体医薬(キメラ抗体)が承認されたのは1994年で、それまでに約8年を要しています。以降、ヒト化抗体(1997年)、抗体の一部を利用した抗体断片(1998年)、ヒト抗体(2002年)、コンジュゲート抗体などの技術革新を背景に製品開発が進み、市場が拡大したという経緯があります。
核酸医薬もDDSや疾患関連遺伝子やタンパク質の制御に関する技術革新に伴って、抗体医薬と同様の展開をたどると、当社は予測しております。
アプタマーを含む核酸医薬の市場は、2011年のシードプラニング社の調査では、2010年では20億円、2015年には300億円、2020年には5,000億円になると予測しています(参考資料4)。しかし、この予測は現在開発中の核酸医薬の開発の進捗状況、製品上市の時期、当該品目の市場性等により大きく変動する可能性があります。
核酸医薬には、アプタマーの他に、アンチセンス、デコイ、siRNA、microRNAなどの種類があります。現在の開発の主流はアンチセンスですが、依然として幾つかの課題(化学修飾、DDS及び製造と品質管理)が指摘されています。
今後、核酸医薬の中軸を担うのは、化学修飾が容易で細胞内へのDDS技術が不要であり、抗体と類似した作用メカニズムを持ち、応用範囲の広いアプタマー医薬だと、当社は考えております。
(ⅲ) アプタマー医薬の現状と課題
2004年12月、世界初のアプタマー医薬で、眼科領域の疾患である加齢黄斑変性症を適応症とする「MacugenⓇ」が米国FDAに承認され、逐次世界各国で承認を得て、世界的な製薬企業であるファイザー社から発売されました。なお、日本では2008年10月に発売されています。
市販1年目の2005年には米国だけで200億円近い売上を計上しました。しかし、翌年の2006年には、競合品の抗体医薬「LucentisⓇ」の上市により市場が奪われたことにより売上が急激に低下し、現在の売上は全世界で10数億円程度と思われます。
現時点では、アプタマー医薬で市販されているのは、「MacugenⓇ」のみです。PⅡ(フェーズⅡ試験)~PⅢ(フェーズⅢ試験)の後期臨床ステージにある開発中の製品は増加していますが、その数は抗体に比較すると些少です。
アプタマー医薬の開発が抗体医薬ほどに進まず、製品化が遅れている主な理由として、以下の二つが考えられます。一つは、アプタマーの創製に不可欠な技術であるSELEX法(後述)に関する基本特許が米国のアルケミックス社に押えられ、日米欧の製薬会社がアプタマー創薬のための研究活動を自由にできなかったことです。二つ目は、アルケミックス社と提携した場合も、アルケミックス社がアプタマーの創製を独占した結果、医薬品化に必要なアプタマーの最適化※10(改変・改良等)を十分に行えず、臨床ステージに上げられるアプタマーの創製に到達できなかったことです。
アルケミックス社と提携した製薬会社のアプタマー医薬の開発が進展しなかったことや、「MacugenⓇ」が競争から脱落した事例は、アプタマー医薬の開発(アプタマー創薬)に幾つかの教訓、課題を与えました。
その一つは、創薬ターゲットとする疾患関連タンパク質とそれに対応するアプタマー選択の問題です。
アプタマー創製の技術(SELEX法)に習熟すれば、特定のタンパク質のみに結合するもの、そのサブタイプにも結合するものなど、目的に応じて様々な特性を持つアプタマーの取得が可能となります。
しかし、「MacugenⓇ」の開発において、加齢黄斑変性症は血管内皮増殖因子(VEGF)が関与しているとの知見から、VEGFの様々なサブタイプ(基本的な役割は似ているがタンパク質を構成するアミノ酸に僅かな違いがある)の中から、加齢黄斑変性症の主因と考えたVEGF-165のみを阻害するアプタマー(Pegaptanib)を有効成分として選択しました。世界初のアプタマー医薬として、安全性を考慮したこの選択自体は決して誤ったものではないと当社では考えております。
これに対し、後続の抗体医薬「LucentisⓇ」は、VEGF-165だけでなく他のサブタイプも阻害し、効果の点で、「MacugenⓇ」を上回り、加齢黄斑変性症に対する第一選択薬としての地位を確保しました。
なお、「MacugenⓇ」は、安全性において「LucentisⓇ」を凌ぎ、また、二剤の併用による患者様のQOL※11の向上が期待できることから、現在、併用療法等の臨床試験が行われています。
二つ目は、臨床試験に入る前の開発途上のアプタマーの最適化(改変・改良等)の問題です。核酸を成分とするアプタマーは体内に投与されると生体内の核酸分解酵素により数秒で分解されます。そのため、体内での作用時間を延ばそうとすると、アプタマーに様々な改良を加えて酵素耐性の向上を図り体外への排出を抑制する必要があります。このアプタマーを医薬品として最適な化合物に仕上げる技術を欠くと、たとえ標的分子に結合し、その生理作用を阻害するアプタマーを創製できても、医薬品として開発するのは困難で、結果として開発は進展せず、製品化できなくなります。
これまでに、アルケミックス社を中心として多くのアプタマーが創製、開発されてきましたが、抗体と比較し臨床ステージにある品目が少ないのは、標的としたタンパク質の選定の問題の他に、アプタマーの最適化が不十分であったという事情があるものと当社は考えております。
三つ目は、抗体医薬との差別化をどう図るかということです。後述するように、アプタマーは抗体と比べて優れた点が多々あり、新薬のシーズとして大きな可能性を秘めています。しかし、抗体には標的に結合し、その作用が長時間持続するという、長所とも短所ともなりうる特徴があります。
反面、アプタマーは、最適化を図っても、全身投与で抗体のように1~2ケ月間も作用させることは困難なため、基本的には、急性期、あるいは短期間を挟む間欠投与の適した疾患や症状が、その本領を最も発揮できる対象だといえます。このため、同一のタンパク質を標的とする抗体と競合する場合、抗体が適していない疾患や投与方法をデザインすることが肝要です。
四つ目はCMCです。CMCとはChemistry, Manufacturing and Controlの略語で、医薬品成分の化学的属性や製造管理をいいます。アプタマーは化学合成により製造しますが、抗体ほどではなくとも長大で複雑な構造をした化合物です。しかもRNAという新規の素材を有効成分とするため、品質・規格の設定や製造・品質管理の方法などは、低分子の手法や基準をそのまま適用できません。
このように、アプタマー開発にあたっては、個々のアプタマーごとに個別に品質や規格などを定め、規制当局との協議を通じて新たな基準を構築する必要があるため、CMCに関する十分な知識や経験を必要とします。
(ⅳ) アプタマー医薬の将来性
アプタマー医薬の市場に関しては、現在、臨床試験の後期(PⅢのステージ)段階に入っている製品が複数ありますが、製造販売承認の取得期間などを考慮すると、2015年前後までは眼科領域の加齢黄斑変性症薬「MacugenⓇ」一品の状態が継続するものと思われます。
しかし、今後、現在開発中(特にPⅡ~PⅢのステージ)のアプタマー医薬が世界的に承認され上市されれば、2020年以降には、核酸医薬市場の一定のシェアを獲得できると当社は考えております。
米国 BCC Research社は、全世界のアプタマー医薬の市場が、2012年の13百万ドル(約13億円)から、2017年には17億ドル(約1,700億円)に拡大すると予想しています(参考資料5)。
また、2011年に公表された文献によると、アプタマー医薬は近い将来、医師にとって標準的な手段になると期待されています(参考資料6)。
(ⅴ) アプタマー医薬と抗体医薬の比較
アプタマー医薬は分子標的薬※12として、抗体を成分とする抗体医薬と、作用メカニズム及び投与方法が類似しています。従って、アプタマー医薬の最大の競合品は抗体医薬になります。アプタマー医薬市場の将来性は、抗体医薬との比較のなかで、その違いを明確にし、どう差別化するかにかかっています。
抗体医薬は、マウス等で作製した抗体をヒトで異物として排除されにくいように加工した後、これを産生する特殊な細胞を大量に培養し、精製して医薬品原料にします。その起源が生物試料であることから生物製剤に分類されます。これに対し、アプタマー医薬はその成分であるRNAを化学合成して製造することから合成医薬品に分類されます。
以下は抗体医薬と比較したアプタマー医薬の特徴ですが、アプタマー医薬は、科学技術の進歩とともにその長所が認識され、抗体に続く次世代の新薬の核として開発が進むものと当社は期待しております。
⦅アプタマー医薬と抗体医薬の比較⦆ (当社作成)
| 項目 | アプタマー医薬 | 抗体医薬 |
| 標的タンパク質に対する結合力 | 抗体の1,000倍は可能 | 強い |
| 創薬ターゲットの種類 | 極めて多様 | 抗原タンパクに限定 |
| 製造 | 化学合成法 | 細胞培養法 |
| コスト (製造コスト低減の容易さ) | 比較的高価 (製造コスト低減の期待あり) | 比較的高価 (製造コストの低減は難しい) |
| 抗原性/免疫排除 | 起きにくい | 起きる |
| 製剤の可逆性・安定性 | 強い | 弱い |
| 体内動態(長時間作用) | 苦手、限界あり | 良い、得意 |
| 短期作用性 | 得意 | 困難 |
| 加工・化学修飾 | 容易 | 困難 |
| 開発・販売の歴史 | 短い | 長い |
| 上市実績 | 一品 | 多くの製品 |
[標的タンパク質に対する結合力]
薬効を及ぼす生体内の標的(疾患関連タンパク質など)に対してどの程度強く結合するかを示す指標としては、解離定数(Kd:dissociation constant)という専門的な用語が用いられます。この解離定数は数値が低いほど、結合力が強いことを意味します。平均的な抗体の結合力は、Kd値がnM(ナノモラー、10-9モラー)レベルで、それ以上強い抗体を作ることは容易ではありません。一方、平均的なアプタマーのKd値はnM以下で、pM(ピコモラー、10-12モラー)のアプタマー、つまり抗体の1,000倍強い結合力を持つアプタマーの作製が可能です。
また、強い結合力は、標的タンパク質を速やかに捕捉し、結合したら離れにくいという性質となるため、アプタマーは高い阻害効果を持つと期待されます。
[創薬ターゲットの種類]
抗体は、創薬ターゲット(抗原タンパク質)を動物に投与して作製します。そのため、精製が難しいタンパク質や、ヒトと動物とで違いが少ないタンパク質など、抗原の種類によっては取得が困難、あるいは、不可能なものもあります。一方、アプタマーは、動物は使わずに、試験管の中の操作のみで作製するので、細胞表面に提示された状態の創薬タンパク質を標的として利用したり、ヒトと動物とで違いが少ないタンパク質に対しても創製することが可能であり、創薬ターゲットの種類が非常に多様です。さらに、創薬ターゲットに結合してその作用を阻害するアプタマーだけでなく、将来的には、抗体では難しいとされる受容体に直接作用するアゴニスト・アプタマー(受容体作動薬)、さらに細胞内に他の医薬品を運搬するためのドラッグ・デリバリーシステム(DDS)として利用可能なアプタマー等を創製することが可能です。
[製造]
抗体は製造規模の大小を問わず、現在の科学技術では化学合成による製造はできません。商品化された場合には、通常、大規模な細胞培養設備によって製造します。また、開発段階で数度にわたるスケールアップを要し、それに対応する設備のために多額の資金が必要となります。加えて、製造条件の変更に伴う品質の確認作業(比較試験)も複雑になります。
一方でアプタマーは、商品化後も、比較的小規模な製造設備での化学合成による製造が可能で、しかも、同一の設備を他の核酸医薬品(アプタマーやアンチセンス等)の合成のために使用できます。そのため、アプタマーでは設備投資も製造管理(スケールアップを含む)も容易であるといえます。
[コスト(製造コスト低減の容易さ)]
抗体医薬は細胞培養による生物製剤のため、製造方法が一旦確立すると、細胞培養等の工程を含むために、製造方法の変更や製造コストの低減は容易ではありません。これに対して、アプタマーでは、今後、製造施設や原材料を共用できるアンチセンス、siRNAやmicroRNAなど他の核酸医薬の発展に伴い、核酸医薬全体での製造スケールの拡大が見込まれることから、そうしたスケールメリット、加えて合成機械や合成方法の技術革新による製造コストの低減が期待されます。
[抗原性/免疫排除]
抗体は生物由来のものを成分とする生物製剤のため、ヒトに投与した場合、抗原性を示すことがあり、継続使用において免疫的な排除を受けるリスクがあります。つまり、抗体を排除するための中和抗体が生体内で作られた結果、効果が減弱するということになります。しかし、アプタマーは合成医薬品のため、ヒトで抗原性を示すことはほとんどなく、また、生物製剤でないため、中和抗体ができるというリスクが低くなっています。
[製剤の可逆性・安定性]
抗体の組成はタンパク質であるため、熱等の要因によって、不可逆的な(元に戻らない)変性を受けやすく品質確保には特別な注意が必要です。これに対し、アプタマーの組成はRNAであり、分解酵素のない環境下では安定しています。また熱等によって立体構造が変化しても、その変性は可逆的(元に戻る)で、100℃以下では速やかに元の形に復帰し、活性を回復します。そのため、アプタマー医薬は製剤化や流通、保管が抗体医薬に比べて容易です。
[体内動態(長時間作用)]
抗体は、特別な加工を施さなくても、血中で分解されにくく、分子量が大きいため腎臓からの排泄も受けにくい性質があるため、血中に長く滞留することができます。一方アプタマーでは、未加工の状態では、血中で核酸分解酵素による消化を受けやすく、中サイズの分子量で水との親和性も高いため、腎臓からの排泄を受けやすい性質があります。そのため、アプタマーは、化学的な修飾を施して酵素による消化を防ぎ、ポリエチレングリコール(PEG)のような油性の高分子化合物を結合するなどの加工が必要ですが、逆にこうした加工方法を工夫することで、血中滞留時間を調節できるという利点があります。
[短期作用性]
医薬の中には、長時間体内に滞留することが副作用の原因となる場合がありますが、アプタマーでは、体内での滞留時間が比較的短いという特徴を生かして、短期に作用する医薬の開発が可能であり、さらに加工の方法により、目的と効果に応じた体内動態の医薬を開発することも可能です。
[加工・化学修飾]
抗体は生物製剤であるため、品質や薬効を向上させるための化学的な加工・修飾が容易ではありません。しかし、アプタマーは化学合成によって製造するため、低分子医薬品と同じように様々な化学的な加工・修飾が可能で、品質や薬効の向上のみならず、作用時間の延長や副作用等の回避の手段を講じることができます。
特にアプタマーでは、複数の標的(疾患関連タンパク質)に結合する二種のアプタマーを一つの化合物として合成し、複数の標的に作用する新薬を開発することも、技術的に可能です。
[開発・販売の歴史]
抗体の開発・販売の歴史については(ⅱ)核酸医薬の市場を、アプタマーについては(ⅲ)アプタマー医薬の現状と課題の項をご参照下さい。
[上市実績]
抗体の上市実績については(ⅰ)医薬品市場を、アプタマーについては(ⅲ)アプタマー医薬の現状と課題の項をご参照下さい。
(2)創薬プラットフォーム
① 創薬の戦略とアプタマー
製薬企業が新薬の素材として何を選択するか、という観点からみると、現在の医薬は、大きく以下の4本の柱から成ると当社では認識しております。この中で最も新しく、技術革新が進展しているのが、生物製剤の中の抗体医薬と、核酸を成分とする医薬であると考えております。

上記の4本の柱の内、低分子を対象とした日本の創薬力は欧米と同等のレベルまで達していますが、抗体やワクチンについては大きく遅れています。
第4の柱である核酸医薬も、日本で初めて創製された、日本発の核酸医薬としてヒトでの臨床試験のステージに入っているものには、NF-κβデコイオリゴとNS-065/NCNP-01(アンチセンス)があります。しかし、既にPⅡやPⅢに入っている多くの開発品を有する欧米と比べて、遅れていることは確かです。
その中で、唯一、アプタマー医薬については、若干の遅れはあっても、大きな差はまだついていません。アプタマー医薬は、前述のように核酸医薬の中核となる可能性を秘めております。
② 新薬開発プロセス
新薬の研究開発は、下記の図に示すように、製品の上市までに、10数年の長い年月と数百億円もの多額の資金を要します。
この新薬の研究開発は、通常、臨床試験前の段階と臨床試験に二分され、さらに臨床試験前の段階は、大きく以下に分けられます。
1)新薬候補と考えられる化合物を考案、創製し、その中から様々な手法を用いて適切な化合物をスクリーニ
ング※13する基礎・探索研究の段階
2)選定された化合物について、臨床試験に進むために必須の試験を行う前臨床試験※14の段階
当社では、新薬開発プロセスの中の(1)基礎・探索研究、及び(2)前臨床試験の段階において、「RiboARTシステム」を運用しアプタマー医薬の開発を行っています。標的タンパク質の種類や特性、適応疾患などによって差は生じるものの、「RiboARTシステム」の活用により、従来なら5~8年かかる基礎・探索研究及び前臨床試験の期間(1年前後のGLP試験※15の期間を含む)の内、標的タンパク質の決定からGLP試験を開始するための予備毒性試験※16ステージまでを、約3~4年で実施可能(当社実績)であると考えております。
⦅新薬開発プロセス⦆
 ※:前臨床試験(3~5年)にはGLP試験の期間1年前後が含まれています。
※:前臨床試験(3~5年)にはGLP試験の期間1年前後が含まれています。③「RiboARTシステム」を用いたアプタマー創薬
当社の「RiboARTシステム」は、シーズ・アプタマー(疾患に関連するタンパク質に結合する候補アプタマー)の取得から最終的な臨床開発品の創出までのプロセスをカバーする、当社独自のアプタマー創薬の技術プラットフォームです。東京大学医科学研究所における研究成果や技術をベースに、当社の研究成果や創意工夫、ノウハウ※17等を含んでいます。
「RiboARTシステム」においてコアとなる技術は、目標とする創薬ターゲット(タンパク質)に結合するポテンシーの高いアプタマーを取得する技術(SELEX法運用技術)と、取得したアプタマーを臨床開発品として最適化する技術です。このコア技術が、意図した薬効を示すポテンシーのアプタマーを取得・創製するうえで大きな効果を発揮します。
本システムでは、取得したアプタマーを新薬候補品となり得るように、加工プロセスによって、標的への結合力を103~104倍に増強し、pM(ピコモラー、10-12モラー)未満のKd値の達成を標準化しており、これが当社の技術的な強みと認識しております。
「RiboARTシステム」の詳細は以下のとおりです。
(ⅰ) アプタマーの取得技術(SELEX法運用技術)
アプタマー創薬のコアとなる技術の一つは、目標とする創薬ターゲット(タンパク質)に結合するアプタマーを取得するSELEX法に関する技術です。この方法は日欧では平成23年6月まで特許で守られ、権利者(アルケミックス社)からライセンスを取得しない限り、SELEX法を実施して自由にアプタマーを取得することはできませんでした。
当社は、この特許が国内で有効であった平成18年10月より、権利者から実施ライセンスを受け、様々なSELEX法を駆使してアプタマーを取得する経験を積んでまいりました。
平成23年6月の日欧での上記特許失効後は、誰でもアプタマーの取得にSELEX法を実施することが可能となりました。しかし、目標とするタンパク質に結合し、意図した薬効を示すポテンシーのあるアプタマーを取得するには、標的タンパク質の特性分析、最適な核酸プールの構築に始まり、様々な条件下でのSELEX法の実施経験やノウハウが必要となります。当社の「RiboARTシステム」はこれらを集大成した創薬技術です。
SELEX法とはRNAの造形力を利用して、目的とするアプタマーを探し出すための技術で、様々なタンパク質を標的に使用できる汎用性が特徴です。具体的には、様々なタイプのRNA分子を標的のタンパク質と何度も結合→解離→増幅→再結合を繰り返すことで、より強く結合するRNA分子のみを“進化”させる技術です。この方法は、以下に示す魚釣りに似ています。
| 1)4種類の塩基(A・U・G・C)がランダムに配列されたRNA(様々なタイプの魚)の入ったプール(釣り堀)に標的となるタンパク質を「餌」にして、結合する(食いつく)特定のRNA(数百種の魚)を釣り上げます。 2)釣ったRNA(魚)からタンパク質(餌)を外し、増幅して(養殖して数を増やす)、再度プールの中に放し、同じタンパク質(餌)で釣りを繰り返します。早く食いついた数十から数百種のRNA(魚)を増幅(養殖)し、再度、釣りを行います。 3)このサイクルを10数回行うことによって、標的タンパク質に強く特異的に結合するアプタマー(最も早く餌に食いつく魚)を数種類選択することができます(右図参照、参考資料7)。 | ⦅SELEX法のイメージ⦆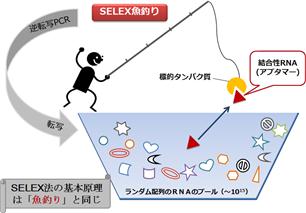 |
SELEX法を利用したアプタマーの創製(取得)には、最初にプールに放つ魚群の選定(核酸ライブラリーの構築)や釣り方(試験方法等)について、長年の経験・実績によるところが多く、当社はSELEX法に関して、世界でも有数の高度かつ広汎的な技術を有しております。
(ⅱ)アプタマーの最適化技術
アプタマーの最適化技術は、in vitro※18 や in vivo※18試験でのスクリーニングから、より効果が高い(標的タンパク質に強く結合し、そのタンパク質の生理作用を高度に阻害する)アプタマーを創製し、アプタマーの改良技術を駆使して、臨床開発品として完成させるものです。
これには、アプタマーに特化したスクリーニング手法だけでなく、取得したアプタマーの特質と用途に応じた個別の最適化(短鎖化、化学修飾等)技術が必要で、当社の最大の強みは、この分野での豊富な知識と経験並びに技能が蓄積していることであります。
また、的確な最適化には、標的タンパク質の特性(分子量、立体構造、電気化学的性質、類縁タンパク質(サブタイプ)の有無等)に応じた最適化のデザイン力が必須です。当社には、このデザインに関しても研究実績を蓄積してまいりました。
| a) アプタマーの短鎖化 アプタマーの短鎖化技術は目標とするタンパク質に結合するものとして選定、取得したアプタマーを、工業的、経済的に利用可能な限度にまで短くし、目的に応じた化合物に改変する技術・ノウハウです。 SELEX法で最初に取れる、塩基が長く連なるアプタマー(約80鎖長)を、タンパク質との結合力を維持しながら1/2程度にまで短くし(短鎖化)、次の化学修飾プロセスにまわします。 | ⦅アプタマー短鎖化のイメージ⦆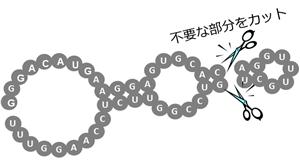 |
| b) アプタマーの化学修飾 アプタマーの修飾技術は、短鎖化したアプタマーを化学的に修飾することにより、アプタマーの持つ生理活性を増強するとともに、薬物体内動態(作用時間)を改善し、医薬品に適したアプタマーに改良する技術・ノウハウです。 具体的には、体内の酵素によるアプタマーの分解を阻止するために、一つ一つの塩基に化学修飾を施したり、腎臓からの早期の排出を抑えるために、アプタマーの末端へ化合物(PEGなど)を結合させたりします。 このような、短鎖化や化学修飾等による最適化作業 | ⦅アプタマーの修飾技術のイメージ⦆ 化学修飾を駆使し最適化  |
を、in vitro や in vivo 試験で効果を確認しつつ繰り返し、より優れた臨床開発品へとアプタマーを磨き上げていきます。
(ⅲ) アプタマーの製造法、品質規格の設定、品質管理等のノウハウ
| 核酸医薬、特にアプタマー医薬は、これまで「MacugenⓇ」が承認、販売されていますが、アプタマー医薬自体の歴史が比較的浅く、薬事規制面でも、原薬アプタマーや完成品の品質や規格に関する規制内容は標準化されていません。 特にCMCの分野では、個々のアプタマーごとに薬事承認や臨床試験の開始までに必要な試験やその方法、分析方法等を企画し、場合によっては薬事当局との協議が必要になります。当社は、そのために必要な、以下の分野の知識、経験も有しております。 | ⦅核酸の塩基配列の解析イメージ⦆ |
・アプタマーを医薬品化するために不可欠な製造方法、品質規格の設定、品質管理
・アプタマーの血中での濃度測定
・核酸やアプタマーのような高分子化合物の分析、核酸の塩基配列の解析法
④ その他の創薬体制
当社はさらに、アプタマー医薬の開発のために、以下の体制を整えております。
(ⅰ) アカデミアでの研究成果の取り込みと連携及び共同研究
当社は、発足の経緯から、東京大学医科学研究所で培ってきたRNA科学やアプタマーに関する成果を実用化するため、トランスレーショナル・リサーチ※19を継続的に実施してきました。
東京大学との共同研究は現在も継続し、同医科学研究所・クレストホール内にも自社の研究室を設置して、同研究所内の動物試験施設やRI(ラジオアイソトープ)試験設備、その他の高度試験装置を使用できる恵まれた環境を維持してきました。これにより技術、信頼性の観点から、高レベルの研究体制を整備しております。
当社は、東京大学以外のアカデミアとも共同研究を実施し、疾患に関連するタンパク質の学術的な裏付けを得ると当時に、各種動物試験の実施、アプタマーの分析等における連携を図っております。
(ⅱ) 的確な研究開発マネジメント
当社では、新薬開発ステージに応じた試験研究の内容、当該試験結果のクライテリアの設定、知的財産戦略等について、新薬開発のノウハウを熟知したスタッフによる定期的なレビューなどの研究開発マネジメントを実施しております。
(ⅲ) 人的ネットワーク
アプタマーを含む核酸医薬の研究開発は日進月歩の状況にあり、世界的に競争が加速しています。当社は核酸科学やアプタマーに関する研究者・研究機関との、世界的規模の人的ネットワークを通じて、最新の研究動向の把握に努めております。
(ⅳ) アプタマー創製のスペシャリスト
当社では、役職員の3/4が、化学、細胞・生物、工学、医学等の分野での専門家(研究員)であり、研究員の約半数は博士号の保持者です。これらの研究員は、アプタマー医薬に特化した研究開発に従事しており、この分野では強力な布陣をしいております。
さらに、大手製薬企業で研究開発や知財・ライセンス事業の経験を長く積んだ社員も擁しており、臨床開発やライセンスに連なる基礎・探索研究の方向づけや知財戦略を展開しております。
(3)創薬事業
①当社のビジネスモデルについて
当社の創薬事業は、(ⅰ)自社創薬及び(ⅱ)他の製薬企業との共同研究という二つから構成されています。
自社創薬とは、一定の開発段階まで自社独自で医薬候補となるアプタマーを開発し、その後、その成果を製薬企業にライセンス・アウトし、契約締結時に受け取る契約一時金、開発進行に伴うマイルストーン収入、及び製品上市後の売り上げに応じたロイヤルティーを得る事業です。
これに対し、共同研究とは、アプタマー医薬の研究を提携製薬企業と共同で行い、当社が分担する業務に応じて提携先から支払われる研究費を収入として得る事業です。さらに共同研究では、アドバイザリー契約を除いて、一定の開発段階に達した時点で提携先の製薬企業に当社分の権利をライセンス・アウトし、相応の契約一時金やマイルストーン収入等を得てまいります。
自社創薬によるライセンス・アウトに依存しすぎると、ライセンスの成否やその成約の遅れ等により事業計画が大きく影響を受けます。他方、共同研究は安定的な共同研究収入を一定期間期待できます。
従って、自社創薬に共同研究の特徴をうまく組み合わせることで、以下の成果あるいは効果が期待できます。
1) 自社創薬のビジネスモデルに伴う収益の不安定化というリスクを低減できる。
2) 共同研究先の新薬開発のノウハウ、経験を知得できる。
3) 共同研究が順調に進む場合、ライセンス・アウトの実現可能性が高い。
4) 事業を全体として拡大できる。
⦅自社創薬及び共同研究における一般的な収益計上のタイミング⦆
 注:上記の図は、一般的なケースとして当社が想定している収益計上のタイミングを表すものです。
注:上記の図は、一般的なケースとして当社が想定している収益計上のタイミングを表すものです。個別の契約によりそれぞれの金額や受取回数等が異なる場合があります。
(ⅰ)自社創薬について
新薬の開発において、基礎・探索研究、前臨床試験、臨床試験へと開発のステージが進捗するに従い、その経費は大幅に増加します。
また、臨床試験ステージになると、自社で開発を推進する場合には臨床試験用の社内体制を備える必要が生じ、さらにPOC※20確認後の臨床試験では、適応症にもよりますが、被験者数が飛躍的に増え、費用が莫大になります。上市後のマーケティング戦略を視野に入れた対応も必要となります。従って、POC確認後の臨床開発は、資金、経験やノウハウを有する製薬企業にて実施することが、アプタマー医薬の成功確率を高め、かつ早期の上市につながると考えております。
これらの事情に鑑みて、当社としては、自社での研究開発の将来目標はヒトでの薬効が確認された時点(POC確認時点)としております。ただし、早期事業化の品目として選定したテーマである場合や、ライセンス先の製薬企業との間で合意が成立した場合は、それ以前であってもライセンス・アウトを実施いたします。
なお、ライセンス・アウト後は、当該品目の開発や製造、販売などはライセンス先がその責任で行うことになります。しかし、当社のアプタマー医薬に関する知見が必要な場合、一定期間、共同研究を行うことがあります。
(ⅱ)共同研究について
共同研究は、製薬企業(提携先)とともにアプタマー創薬を実現することを目指す共同研究契約と、アプタマー創薬を行っている製薬企業に対するアドバイザリー契約があります。具体的には、共同研究契約では、創薬のターゲットとなる疾患関連タンパク質は提携先の領域戦略などに従って選択され、当社はかかるタンパク質の生理作用を阻害・抑制し、提携先が求める基準を満たすアプタマーを創製いたします。提携先はそのアプタマーについて薬効等の確認・評価(スクリーニング)、安全性試験等を行い、早期に臨床試験の対象となる臨床開発品を特定し、以降は提携先のイニシアティブで臨床開発を推進します。アドバイザリー契約では、アプタマー創薬を行っている製薬企業に対し、アプタマー医薬開発に関する試験研究の受託、技術指導を行っております。
共同研究では、製薬企業との間で作業分担を定めますが、当社が分担するアプタマーの創製に関する研究活動に対しては、適切な対価を得ることとしております。この役割分担に関しては、双方の有する技術や知識、経験をベースとして協議により決定しますが、当社の主な役割はアプタマーの創製やその改良となります。なお、当社では、共同研究の対価として受取る収入は共同研究収入として事業収益に計上し、試薬等の実費補填として受取る収入は受取研究開発費として営業外収益に計上しております。
また、共同研究では、当社のアプタマー医薬の開発に関する知識や経験を深めることが可能となり、さらに、アドバイザリー契約を除いて、一定の開発段階に至った場合、共同研究先へライセンス・アウトすることを前提としているため、ライセンス・アウト実現の可能性が高く、ライセンス先を探す必要もほとんどありません。
現在、当社が推進しているアプタマー創薬に関する共同研究は以下のとおりであります。
| パートナー名称 | 共同研究概要 |
| 大塚製薬株式会社 | 平成20年1月1日付共同研究契約に基づく「RBM002」に関する共同研究 平成20年1月1日付共同研究契約に基づく「RBM003」に関する共同研究 平成22年6月10日付共同研究契約に基づく「RBM001」に関する共同研究 |
| 全薬工業株式会社 | 平成23年2月より同社が選定した創薬ターゲットについての技術アドバイスに関連する業務を受託。 平成24年4月より、同社が選定した創薬ターゲットについての研究に関連する業務を上記契約に追加。現在は、平成25年4月1日付技術アドバイスおよび試験実施に関する覚書に基づき、同業務を継続。 |
| 大正製薬株式会社 | 平成26年3月に締結した共同研究契約に基づく、同社が選定した創薬領域に関する共同研究 |
②パイプラインについて
創薬事業(自社創薬及び共同研究)のパイプラインのうち、基礎・探索研究段階を終え前臨床試験に進んでいるプロジェクトは下記のとおりです。
〈各パイプラインの進捗⦆
 ※:平成26年4月に藤本製薬株式会社にライセンス・アウトいたしました。
※:平成26年4月に藤本製薬株式会社にライセンス・アウトいたしました。(ⅰ)自社創薬パイプライン
自社創薬の疾患領域と当該疾患領域における主要なパイプラインの概要は以下のとおりです。
a) 疼痛領域(RBM004:抗NGFアプタマー)
痛みは体の異常を伝える重要なシグナルですが、時にQOLの質を損ない、様々な生活上の支障をもたらします。このため、多くの鎮痛薬が開発され市販されてきました。
2012年度の日米欧の鎮痛剤の市場は1兆8,523億円で、米国市場が59.3%のシェアを持っています。その中で最も大きな市場を占めるのが強力な鎮痛作用を持つモルヒネなどのオピオイド(医療麻薬)製剤で、7,368億円の市場を構成しています。
| <2012年・日米欧の鎮痛剤市場規模> | <2012年・種類別鎮痛剤市場規模> | ||||
| 地域 | 市場規模 | シェア | 鎮痛剤の種類 | 市場規模 | |
| (単位:百万円) | (%) | (単位:百万円) | |||
| 米国 | 1,097,900 | 59.3 | NSAIDs(外用剤含む) | 328,400 | |
| 欧州 | 388,700 | 21.0 | COX-2阻害剤 | 227,100 | |
| 日本 | 365,700 | 19.7 | オピオイド | 736,800 | |
| 片頭痛治療薬 | 183,300 | ||||
| その他 | 376,700 | ||||
(参考資料8)
オピオイド製剤にはモルヒネやオキシコドンなど様々な種類があり、また、多くの新製品が開発されています。何れの製品も即効性で効果が強い反面、耽溺性や嘔吐等の副作用があり、長期間の持続的な鎮痛に用いることは難しく、また、その乱用を防止するために保管、流通、使用が厳しく規制されています。
市場には多くの鎮痛剤がありますが、オピオイドと同程度の鎮痛効果があり、長期間(1~2週間)その作用が持続し、かつ依存性や耽溺性がなく、中小病院や診療所でも安心して使用できる製品は無く、鎮痛剤の市場にも未だにUnmet Medical Needsの領域が残っています。
| そのなかの一つに癌性疼痛があります。癌の激しい痛みにはオピオイドが用いられていますが、使い方が難しく、また、鎮痛作用の持続時間が短く、依存性や嘔吐等の副作用があり、保管や取扱にも、世界的に厳しい規制がなされています。 癌性疼痛薬については、オピオイド系の医薬品が市場にあり、また次々と開発されていますが、1回の投与で1週間ないし2週間、麻薬と同等の鎮痛効果を持つ医薬品は、開発途上のものを含め見当たりません。 痛みの強さによる鎮痛剤の選択及び鎮痛剤の段階的な使用法を示した、癌性疼痛除痛ラダーがWHOより示されています。当社では、オピオイドに代替し、 | ⦅WHO癌性疼痛除痛ラダーと抗NGFアプタマー⦆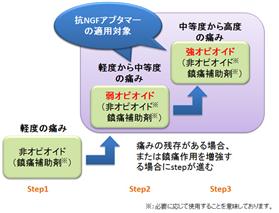 |
または併用によってQOLを高めるアプタマー医薬の開発を進めております。
さらに、この分野だけでなく、手術後や痛風、リウマチの急性期での疼痛など数日続く重度の痛みに対し、単回での投与でその痛みが寛解する医薬品にも大きな需要が見込まれます。
この鎮痛剤市場のUnmet Medical Needsを充たす新薬の創薬ターゲットとして当社が狙っているのがNGF(Nerve Growth Factor、「神経成長因子」)であります。
NGFは世界で最初に発見された成長因子で、末梢における疼痛の原因物質として知られています。従って、生体内でのNGFの作用を抑えれば、様々な痛みに対する効果が期待されることから、ファイザー等の世界的な製薬企業が抗NGF抗体を疼痛治療薬として開発しています。
⦅NGFによる痛みの伝達⦆

当社が研究開発中の抗NGFアプタマーは、いずれも抗NGF抗体と同様にNGFの生理作用を阻害し、抗体医薬には無い「1回の投与で2日~7日間(最大2週間)作用が持続する」という優れた特性を示しております。
このアプタマーは、抗体と異なり、作用時間が長すぎないため、医師のコントロールで安全性を確保できますし、さらに、病態モデル動物※21を用いた試験で、オピオイドを代表するモルヒネや抗NGF抗体と同程度の鎮痛効果を示しています。
当社はこれらの特性を活かし、抗体医薬では適さない、術後痛や痛風痛等の短期間での中等度から激しい疼痛に対する第一選択薬、さらには癌性疼痛や関節炎痛等に対する安全性の高い革新的な治療薬となることを狙っております。
抗NGFアプタマーについては、術後痛や癌性疼痛についての病態モデル動物での薬効確認がとれ、ヒトでの臨床試験の対象となる開発候補アプタマーの選定も終えています。また、開発候補アプタマーを用いたラット及びサルでの予備毒性試験も完了しています。
なお、抗NGFアプタマーを含む本プロジェクトに関しては、平成23年までに3件の物質特許が出願済みであり、その内、開発候補アプタマーとして選定したアプタマーをカバーする物質特許出願に関して、平成24年6月に、日本で特許(特許第5027956号)が成立いたしました。欧米その他の国でも本件特許の成立を見込んでおります。なお、本プロジェクトに関する特許の詳細については、後述の(5)知財戦略③主要な特許の状況の項を参照下さい。
平成26年4月、本プロジェクトについて藤本製薬株式会社との間で全世界を対象とした独占的ライセンス契約を締結いたしました。POCを確認するまでは当社も積極的に開発をサポートして新薬の実現に貢献すると同時に、臨床開発に関する経験や知識の蓄積に役立てる予定です。
抗NGFアプタマーは、主たる目標を鎮痛剤として開発してきた製品であります。後述の自社開発品の標的であるATXやFGF2も疼痛の起因に関与する可能性が学術文献で指摘されており、当社で行ったマウスを用いた癌性疼痛モデルにおいて、抗FGF2アプタマーがモルヒネと同等の鎮痛効果を持つことを確認しております。
これらのプロジェクトを合わせて、当社は疼痛分野における新規創薬ターゲットにおいて、可能性を秘めた複数の開発物質(アプタマー)を有しております。
b) 敗血症領域(RBM005:抗HMGB1アプタマー)
敗血症は細菌、ウイルス、菌類による感染がもたらす最も重篤な疾患で、病原菌に対する体の炎症反応が制御不能になり、体の免疫システムそのものが組織や臓器に損傷を与え、多臓器不全、ショックにより高い確率で死をもたらします。
世界的な敗血症の撲滅運動を展開しているGlobal Sepsis Alliance(世界敗血症連盟)の調べでは、毎年、敗血症患者は2,500万人に上り、その内、800万人が死亡しています。
なお、先進医療国である米国でも、毎年75万人が罹患しているとの報告があります(参考資料9)。
敗血症の治療には、抗生物質を始めとする様々な薬剤が使用されていますが、多臓器不全やショックに対する決定的な治療薬はありません。これまで、全世界の製薬企業が敗血症の治療薬の開発を進めてきましたが、市販後に有効性の問題で販売中止や、臨床試験(PⅢ)で所期の成績を得られないなど、開発に成功しているとはいえません。
この敗血症領域におけるUnmet Medical Needsを充たすべく、当社が狙っている創薬ターゲットはHMGB1(High Mobility Group Box 1)であります。敗血症患者の血液中でHMGB1は検出され、特に死亡例では、生存例、健常人に比較し高値を示すため、HMGB1は敗血症ショックを引き起こす主要な因子と考えられています。
HMGB1は細胞の核内のDNAに結合しているタンパク質で、転写(DNAを鋳型にしてRNAを合成すること)に重要な役割を果たしています。しかし、何らかの原因でこれが細胞外に放出されると、糖化タンパク質の受容体(RAGE)と結合して炎症性サイトカインの産生を誘導します。
炎症性サイトカインとは、体内に異物が侵入したときに産生され、生体防御に関与する多種類の細胞に働きかけるタンパク質です。この炎症性サイトカインが何らかの原因で体内に過剰に放出されると、様々な炎症性疾患を引き起こします。
本プロジェクトは、このHMGB1の生理作用を阻害するアプタマーを創製し、敗血症の治療薬として開発するものであります。in vitro 及び病態モデル動物での試験を終えたアプタマーについて、NEDOからの助成資金(平成23年8月~平成26年2月)をベースとして積極的に開発を行い、開発候補アプタマーの創製に到達いたしました。
なお、HMGB1は線維症の発症に関与する可能性もあることから、当社の線維症プロジェクトの1テーマとしても研究を進めております。
c) 肺線維症等の線維症領域(RBM006:抗ATXアプタマー、RBM005、RBM007 他)
体の器官や臓器が線維化して本来の機能を発揮しなくなる疾患に線維症があります。線維症は、肺、肝臓、腎臓、筋肉等に起きますが、当社が最優先に狙っているのは、難治性で癌に移行する可能性が高く、治療満足度の低い重篤な疾患である特発性肺線維症(Idiopathic Pulmonary Fibrosis, IPF)であります。
IPF患者数は、国内での疫学調査では約1.5万人と推定されていますが(参考資料10)、米国での調査(2006年)では、10万人当たり14~42.7人、欧州での調査(2012年)では10万人当たり26人であったと報告されています(参考資料11)。
IPFの治療薬として、従来は抗炎症作用のステロイドや抗凝固剤などが用いられてきましたが、2008年、世界初のIPF治療薬として、抗線維化作用を有するピルフェニドンを成分とする「ピレスパⓇ」が国内で販売されました。
しかし、「ピレスパⓇ」には高い頻度で光線過敏症が認められ(臨床試験において被験者の半数以上)、日常生活での活動が制限されるほか、その効果も限定的です。
従って、現在、IPFに対する治療はその進行の阻止や症状の緩和に限定され、満足度の高い治療薬は世界的に見てもありません。
このようなIPF におけるUnmet Medical Needsを充たすべく、多くの製薬会社が様々な薬剤を開発しています。Global Data社が2013年4月に出した市場調査報告では、米国、フランス、ドイツ、イタリア、スペイン及びイギリスでのIPF治療剤の市場は、2012年の49百万ドルが、2017年には1,100百万ドルになると予測しています(参考資料12)。
当社はIPF だけでなく腎臓や肝臓等の組織における線維症の治療というUnmet Medical Needsを充たすべく、線維症の発症やその進行に関連する以下のタンパク質を創薬ターゲットとして検討し、研究してまいりました。何れも低分子や抗体で十分な成果を上げていないもの、あるいは臨床ステージに入っている他社開発品のないものであります。
| <標的タンパク質> | <対象臓器> | |
| ① ATX | RBM006 | 肺、他 |
| ② FGF2 | RBM007 | 肺、他 |
| ③ HMGB1 | RBM005 | 肝臓 |
| ④ TGF-β※22その他 | ― | 肺、肝臓、腎臓、他 |
上記、線維症の創薬ターゲットの中の重点品目はATX(Autotaxin)であります。
ATXは悪性癌細胞から分泌され、自身の細胞運動性を促進する因子として発見されたタンパク質で、その後、癌細胞以外からの分泌も確認されました。ATXの発現亢進は乳癌、脳腫瘍などの癌、動脈硬化、肺線維症、神経因性疼痛などの疾患に関連するとされ、特許出願を調査したところによると、世界中の企業や大学の研究者がATXの阻害剤を癌や線維症などの治療剤として研究開発しています。しかし、現在に至るまで、抗体を含め有望なATXの阻害剤は得られていません。
当社は、各種肺疾患患者の血清中及び肺胞洗浄液中のATX濃度についての論文報告や、ATXが間質性肺炎・肺線維化を促進するメカニズムについての研究等を精査した結果、ATX阻害のアプタマーが臓器線維症、特に肺線維症に対する有力な治療剤となる可能性を見出しました。そこで、肺線維症をターゲットとして、ATXの生理作用を阻害するリード・アプタマーを創製、最適化し、in vitro 試験及び病態モデル動物(肺線維症動物モデル)での試験で効果を確認いたしました。
このアプタマーについては、NEDOからの助成資金(平成23年8月~平成26年2月)をベースとして積極的に開発を行い、開発候補アプタマーを創製いたしました。現在、臨床試験に入る直前のステージ(GLP試験)に必要なデータを得るため、動物での予備毒性試験を実施し、データ、資料を蓄積しつつあります。また、投与ルートの検討に関連する試験を実施中であります。
線維症は複数の因子が異なるステージで関与する複雑な疾患であると考えられることから、当社では上記のATX、FGF2、HMGB1、TGF-βに、平成26年4月よりさらに探索段階の複数の創薬ターゲットを加え、多角的な視点から線維症プロジェクトに取り組んでおります。
今後、開発の進んでいるテーマ(抗ATXアプタマー及び抗FGF2アプタマー)については、臨床試験に移行するための各種データの獲得に向けた研究を進め、同時に、製薬企業との共同研究あるいはライセンス・アウトのための予備的折衝を開始しております。
d)骨疾患領域(RBM007:抗FGF2アプタマー)
骨疾患領域には、リウマチの進展による関節破壊、癌の骨転移など、十分な治療効果が得られず、また予防できないUnmet Medical Needsが残っています。
関節リウマチの治療については、2000年代に入りTNF-α※23を対象とした抗体医薬が出現し、その進行の阻止や改善に画期的な効果を示し、2012年には全世界で1兆5,000億円を超す巨大な市場になっています。
なお、株式会社富士経済が2012年6~8月に行った調査では、日本での関節リウマチ治療薬トータルの市場は、2011年に1,663億円だったものが2020年には2,370億円に増えると予想されています(参考資料13)。
しかし、抗体でも奏功しない患者が存在することや、破壊された軟骨の修復・復活という面では、抗TNF-α抗体も十分な成果を上げておらず、予防できない分野が残っています。
また、リウマチ患者が骨そしょう症を併発することはよく知られており、リウマチに伴う関節破壊と骨そしょう症を共に防止する薬剤は、Unmet Medical Needsの製品として、大きな可能性があります。
さらに、大きな苦痛と致命的な効果をもたらす癌の骨移転の防止や癌化した骨の正常骨への回復、また骨転移に伴う症状(特に激しい痛み)の緩和に対する薬剤は開発されつつありますが、十分といえる状況ではありません。
当社が上記のような、関節リウマチに伴う関節破壊の防止や改善、さらに骨そしょう症の治療から癌の骨転移の治療とその症状(特に激しい痛み)の緩和という目的で開発しているテーマが抗FGF2アプタマーです。
FGF2(Fibroblast Growth Factor Ⅱ、「線維芽細胞増殖因子2」)は血管の新生因子として広く知られており、その阻害剤(特に抗体)は、主に抗癌剤として内外の製薬企業によって研究されています。しかし、FGF2に特異的に結合し、意図する薬効が得られる抗体医薬の創製は極めて困難なため、未だに十分な成果はあがっていません。
本プロジェクトはこのFGF2の生理作用を阻害するアプタマーを開発するもので、東京大学医科学研究所との共同研究テーマとして推進してきたものです。
当社が開発中の抗FGF2アプタマーの特筆すべき特徴は、骨疾患に対する根本的な治療薬を提供でき、同時に骨疾患における疼痛に対してモルヒネと同等な鎮痛作用を期待できることです。さらに、血管新生を抑制する作用があるため、「MacugenⓇ」とは異なる機序に基づく加齢黄斑変性症に対する治療薬の開発が期待できます。また線維症への用途拡大も見込まれます。
現在、臨床試験に移行するための各種データの獲得に向けた研究を進め、同時に、大手製薬企業との間でライセンス・アウトのための予備的交渉を行っております。
(ⅱ)共同研究パイプライン
共同研究パイプラインの概要は以下のとおりです。
(A)大塚製薬株式会社との提携
a)RBM001
平成22年6月10日締結の共同研究契約に基づき、ミッドカインを創薬ターゲットとし、免疫・炎症性疾患などを対象とするプロジェクトです。これまで複数のテーマ(対象疾患)について研究を行ってきましたが、現在、適応疾患の再検討を行っております。
b)RBM002
平成20年1月1日締結の複数のターゲットを対象とした共同研究契約に基づくプロジェクトの一つで、循環器領域を対象としたものです。現在は血液疾患を対象としたテーマについて、前臨床試験を実施しております。
c)RBM003
上記の平成20年1月1日締結の共同研究契約に基づくプロジェクトの一つで、線維症を対象疾患としたものです。
(B)大正製薬株式会社との提携
同社が選択したアプタマー創薬テーマについて、3年間の共同研究を平成26年3月より開始しております。
③ ライセンス・アウト済みプロジェクト
当社の創薬事業のプロジェクトのうちライセンス・アウト済みのプロジェクトは、以下のとおりであります。
| 区分 | プロジェクト | ターゲット | 導出先 | 権利地域 | 適応症 |
| 自社創薬 | RBM004 | NGF(神経成長因子) | 藤本製薬株式会社 | 全世界 | 疼痛 |
当社は平成26年4月、NGFに対するRNAアプタマーを含有する医薬品の開発、製造、販売に関して、全世界での独占的実施権を許諾するライセンス契約を藤本製薬株式会社と締結しております。
当社は、当該契約の締結に伴う契約一時金を受領しており、今後は開発の進捗等に応じたマイルストーン収入、及び売り上げに応じたロイヤルティーの受領を計画しております。
④ その他
当社は、創薬以外へのアプタマーの応用も行っております。
その一つに、IgGアプタマーがあります。IgGはヒト血清中に最も多く存在(70~75%)する免疫グロブリンで、抗体医薬として実用化されています。
当社は、アプタマー創薬に関する技術開発の過程において、IgGの特定の部分(定常部)に結合するアプタマーを取得し、このアプタマーの機能解析を進めた結果、抗体医薬の分離精製に利用できることを証明いたしました。
本アプタマーに関する特許は平成24年1月に日本において成立(特許第4910195号)し、現在、その商品化のため、大手化学品商社を窓口として製薬企業との協議を行っております。
上記の他に、アプタマーを利用した次世代の基盤技術の開発も進めております。その一つとして、iPS細胞(人工多能性幹細胞)の創製や維持、あるいは分化誘導に関する制御性アプタマーの研究を開始しております。
本研究は、当社の基盤技術である「RiboARTシステム」の新たな応用を目指すものであります。
(4)アライアンスの推進
① ライセンス戦略
当社は、様々な疾患領域のアプタマー医薬を開発できるという基盤技術を最大限に生かすため、一般的な創薬系バイオベンチャーに比べて、比較的早期の研究開発段階(前臨床試験段階からPOCの確認前後段階)においてライセンス・アウトを行うことを基本としております。
当社は東京大学医科学研究所の研究成果を事業化するために発足した大学発のベンチャー企業であったことや、研究実施のために公的資金の提供を受けたプロジェクトも複数例あることから、その成果については、できる限り国内企業へライセンス・アウトすることを意図し、アプローチしてまいりました。
また、当社はこれまで共同研究やライセンス・アウトに連動して、複数の共同研究先及びライセンス先と資本提携も実施し、より強固で統合的な事業推進を図ってまいりました。
今後は、アプタマー創薬に取り組む企業の拡大が見込まれ、それに伴う事業チャンスを活かすために営業活動の地域を海外にも広げ、共同研究やライセンス・アウトの機会の拡大を図ってまいります。
② アライアンスの推進体制
当社におけるアライアンス活動(共同研究やライセンス・アウトの実現)の主管は知財・調査企画部です。
自社創薬品目のライセンス・アウト実現のためには、可能性の高い提携候補先の選定、候補先での導入決定を促す試験成績・データ(製品差別化のポイント、製品売上高の予測、競合品に対する優位性等)の創出、交渉の進展に応じたタイムリーな情報提供、さらには事業化や開発に関する的確な提案、粘り強い交渉などが必要です。
また製薬企業側のニーズの把握と積極的なアプローチも必要です。
これらの活動を行うためには、医薬品業界におけるライセンスや事業開発の経験や、国の内外の製薬企業と広汎なネットワークを有する人材が不可欠です。
このため、当社では医薬品業界での新薬の開発経験と実績のある人材を配置し、知財・調査企画部に医薬品業界の法務・ライセンス部門での豊富な経験を持つ者を擁し、また研究開発や知財に関する社外専門家も活用できる体制を構築しており、アライアンスの実現に向けた体制を整えております。
③ 産学連携、トランスレーショナル・リサーチの推進
当社のコアな技術である「RiboARTシステム」を構築する主要な知識、技術は、東京大学医科学研究所との提携によりもたらされたものであります。
現在においても東京大学や東北大学薬学部、名古屋大学医学部等との緊密な連携を図り、アカデミアでの研究成果を事業化するための開発に移行させ(トランスレーショナル・リサーチ)、その実用化を目指しております。
特に東京大学医科学研究所とは平成17年6月より共同研究による提携を開始し、平成24年4月以降は社会連携講座(「RNA医科学」社会連携研究部門)の下での連携を図っております。
(5)知財戦略
創薬プラットフォーム系バイオベンチャーである当社にとって、開発する製品が特許により保護されていることが、他社とのライセンスや共同研究を実現する上で不可欠です。
当社の知財戦略は、開発する製品に関するものと、開発技術に関するものとに峻別し、以下のような異なる対応をしております。
① 自社創薬品目及び共同研究品目に対する知財戦略
物質特許の取得を必須としております。なお、RNAを成分とするアプタマーは配列の違いによって、同一標的分子(疾患関連タンパク質)について権利範囲の抵触しない複数の物質特許が成立する可能性があります。
このため、標的分子との結合力が強く、かつ、その生理作用に対する阻害活性の高いアプタマーだけでなく、その周辺の化合物も特許でカバーし、さらに、無数にある核酸配列の中から結合力及び阻害活性の高いアプタマーに共通する配列を探索し、その共通配列を特許化することで、広い権利を押えることを基本戦略としています。
また、共同研究品目については、提携先との共同出願となるのが通例ですが、ライセンス・アウトに伴い、開発や事業化についての独占実施権を提携先に付与しても、当該特許に対する自社権利は維持する(共有とする)方針を堅持いたします。
なお、特許の出願国については、日米欧を中心として、中国、韓国、インド、ブラジル等の医薬品市場の規模が大きく、または将来の市場拡大が見込まれる国や地域をカバーすることを狙っております。
②「RiboARTシステム」に対する知財戦略
「RiboARTシステム」のコアとなる技術(アプタマーの取得、短鎖化や化学修飾等の最適化)に関するものの中には、特許化して権利の独占を図れる可能性のある技術も含まれているものと当社は考えておりますが、特許化にはその技術を公開するという代償を伴います。
アプタマーは、その質さえ問わなければ、日欧で既に特許期間が失効したSELEX法を含む公知の方法で取得可能です。そのため、当社の特許化された技術を使用して他社がアプタマーを取得したとしても、それが当社の特許技術を使用したことを立証することは困難で、特許出願に伴う技術の公開は、敵に塩を送るに等しいものです。
従って、当社では、原則として「RiboARTシステム」により創製されたアプタマー医薬品候補物については、特許を取得する方針でありますが、「RiboARTシステム」を構築する技術自体は、特許化による競争優位性が確保されるものを除きノウハウあるいは「営業秘密※17」として秘匿し、優位性の確保に努めます。なお、当社はノウハウあるいは営業秘密が社外に流出しないよう、役職員や取引先との間で秘密保持義務等を定めた契約を締結し、厳重な情報管理に努めております。
③主要な特許の状況
自社創薬品目としてライセンス・アウトしたRBM004(抗NGFアプタマー)をはじめとする、当社の研究開発に関する主要な特許の状況は以下のとおりであります。
⦅自社創薬品目に関する主要な特許⦆
| 対象パイプライン | 発明の名称 | 出願又は特許番号 | 保有者 | 登録状況 |
| RBM004 | NGFに対するアプタマー及びその使用 | PCT/JP2009/066457 | 当社 | 日本にて特許査定、南アフリカにて成立済 |
| NGFに対するアプタマー及びその使用 | PCT/JP2011/057105 (特許第5027956号) | 当社 | 日本にて成立済 | |
| NGFに対するアプタマー及びその用途 | PCT/JP2012/75252 | 当社 | - | |
| RBM007 | FGF2に対するアプタマー及びその使用 | PCT/JP2011/052925 | 当社 | 米国にて成立済 |
| FGF2に対するアプタマー及びその使用 | PCT/JP2012/65029 | 当社 | - | |
| FGF2に対するアプタマー及びその使用 | 特願2014-060966 | 当社 | - | |
| RBM006 | オートタキシンに結合しオートタキシンの生理活性を阻害するアプタマー及びその利用 | 特願2014-067289 | 当社 | - |
| オートタキシンに結合しオートタキシンの生理活性を阻害するアプタマー及びその利用 | 特願2014-090755 | 当社 | - |
⦅共同研究品目に関する主要な特許⦆
| 対象パイプライン | 発明の名称 | 出願番号 | 保有者 | 登録状況 |
| RBM001 | ミッドカインに対するアプタマー及びその使用 | PCT/JP2007/072099 (特許第5190573号) | 当社・大塚製薬株式会社 | 日本を含む45カ国にて成立済 |
| ミッドカインに対するアプタマー及びその用途 | PCT/JP2013/81451 | 当社・大塚製薬株式会社 | - | |
| RBM003 | キマーゼに対するアプタマー及びその使用 | PCT/JP2010/059953 | 当社・大塚製薬株式会社 | ニュージーランドを含む2カ国にて成立済 |
⦅参考資料⦆
| 参考資料1 | 「IMS Health Market Prognosis」,IMS,2013年6月 |
| 参考資料2 | 「Future Pharma, Five Strategies to Accelarate the Transformation of the Pharmaceutical Industry by 2020」,KPMG. Co.,UK,2011年 |
| 参考資料3 | 「2012年 世界の抗体医薬品開発の最新動向と市場展望」, 株式会社シード・プランニング,2012年7月 |
| 参考資料4 | 「核酸医薬品等共同製造施設設置に向けた事前調査」報告書,株式会社シード・プランニング,2011年2月 |
| 参考資料5 | BCC Research 社,2012年10月24日,同社ニュースリリース |
| 参考資料6 | 「Nucleic acid aptamers : clinical applications and promising new horizons」,Current Medicinal Chemistry、Vol.18,No.27,2011年 |
| 参考資料7 | 現代化学,株式会社東京化学同人,2009年11月号 |
| 参考資料8 | 「2013年 世界の疼痛薬市場」, 株式会社総合企画センター大阪,2013年6月 |
| 参考資料9 | 「Severe Sepsis and Septic Shock」,The NEW ENGLAND JOURNAL of MEDICINE,369:9,2013年 |
| 参考資料10 | 「特集 特発性肺線維症(IPF) 序 ~特集企画にあたって~」,医薬ジャーナル,Vol.45,No.7,2009年 |
| 参考資料11 | 「A review of current and novel therapies for idiopathic pulmonary fibrosis」,Journal of Thoracic Disease,Vol.5,No.1,2013 年 |
| 参考資料12 | 「PharmaTimes」,2013年5月8日 |
| 参考資料13 | 「2012 医療用医薬品データブック No.3」,株式会社富士経済, 2012年8月 |
⦅用語解説⦆
| ※1 : RNA | 遺伝情報は生命の設計図ですが、アデニン(A)チミン(T)グアニン(G)シトシン(C)という4種類の塩基の配列として、DNA(デオキシリボ核酸)という(2重螺旋構造の)核酸の中にコードされています。 ヒトならば30億塩基の配列がヒトを作り上げる全情報です。この塩基の並びはタンパク質のアミノ酸の配列を指定して、生命活動を司る様々なタンパク質を産生します。その時、DNAの配列情報は、一旦、アデニン(A)チミンの代わりのウラシル(U)グアニン(G)シトシン(C)の塩基配列に置き換えて、RNA(リボ核酸)という核酸にコピーされ(この過程を「転写」と言います)、その遺伝情報のコピーを使ってタンパク質を合成します(この過程を「翻訳」と言います)。 そのため、分子生物学の黎明期から、RNAは単なる遺伝情報のコピーに過ぎないという思い込みが、世界的にも支配的でした。しかし、10数年前から、この考えは誤りであることが様々な研究によって明らかになってきました。特に立体構造を作って働く機能性RNAの生体内での役割が注目を集めています。 |
| ※2 : RNAの造形力 | 当社は、アプタマーとIgGとの結合体の結晶構造をX線解析法によって明らかにしてNucleic Acids Res誌に発表いたしました(2010年、図参照)。 その結果、既存のアプタマーではRNAのリン酸の負電荷と、標的タンパク質の正電荷のアミノ酸領域とが電気的な相互作用によって結合するものしか知られていませんでしたが(図の右の事例)、IgGアプタマーはこ | ⦅アプタマーとIgG結合体の結晶構造⦆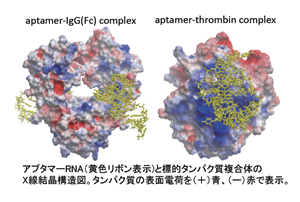 |
| れまでの常識を覆して、アプタマーが標的にフィットするしなやかな形状を作って、電気的な相互作用を使わずに、水素結合やファンデルワールス力のような多様な結合を利用して強く標的に結合することが明らかにされました。 つまり、RNAには、これまで予想もされなかった「しなやかな造形力」が備わっていることの証しです。このような基礎的な研究は、応用という点からも重要です。特に、医薬品の標的となるタンパク質は、必ずしもRNAと結合しやすい正電荷のアミノ酸が表面に多いとは限らないため、これらの基礎研究の成果は、非常に多くのタンパク質がRNAアプタマーの創薬ターゲットとなりうるということを示唆するものです。 | |||||||||||||||||||||||||||||||||
| ※3 : 化学修飾 | 品質や薬効向上のために、化合物の一部の分子や原子を他の分子や原子に置換したり、新たな分子や原子を結合させることをいいます。 | ||||||||||||||||||||||||||||||||
| ※4 : ライセンス・アウト | 特許や開発中の製品に関する権利を他の会社に供与したり、譲渡したりすることを意味し、「導出」ともいいます。供与する権利の内容としては特許の実施権や使用権、さらにかかる特許によって保護されている製品の開発、及び製造・販売する権利などがあります。 | ||||||||||||||||||||||||||||||||
| ※5 : マイルストーン収入 | 医薬品の開発は、前臨床試験→臨床第I相試験(フェーズI)→臨床第Ⅱ相試験a(フェーズⅡa)→臨床第Ⅱ相試験b(フェーズⅡb)→臨床第Ⅲ相試験(フェーズⅢ)→申請→承認→発売というステップを踏んで進行します。 開発途上の医薬品のライセンスにおいては、この開発の節目を「マイルストーン」といい、それに到達したとき、あるいはその段階に入るときにライセンスの対価の一部がライセンサーに対し支払われる取引が普及しています。これによる収入を、「マイルストーン収入」といい、開発ステージが進むにつれて、商品化への確率が高まるため、マイルストーンの収入が増加するのが一般的です。 | ||||||||||||||||||||||||||||||||
| ※6 : 抗体、抗体医薬 | 抗体とは、体内で特定の異物(抗原)に結合してその物質を体内から排除するように働くタンパク質をいいます。この排除システムを抗原抗体反応といい、我々の体内に自然に備わっている防御システムです。 抗体医薬とはこの仕組を医薬品として応用するもので、具体的には、疾患の原因となっているサイトカインなどのタンパク質を抗原として認識する抗体を産生する細胞(主に動物の)を造り出し、その後、この細胞を培養して該当する抗体を取り出し、精製加工します。但し、ヒト以外の動物、例えばマウスの細胞が産生する抗体(マウス抗体)をそのままヒトに使用できない場合があるため、動物からとれた抗体をヒト型に組み替える技術が発達しています。 現在、臨床開発されている抗体医薬の多くは、このヒト化抗体、若しくはヒト抗体です。さらに、複数の抗原を狙ったものや持続時間の長期化のためにPEGと結合させたコンジュゲート抗体なども開発の俎上にのっています。 なお、抗体類似の構造を持ち作用・機能面においても抗体と類似するFc融合タンパク質は、広い意味で抗体医薬の一種に含むこともあります。 この抗体医薬は 難治疾患に対する確かな効果と安全性、高薬価、さらに技術開発があいまって市場が急伸しており、近年、世界的な開発競争が激化しています。 | ||||||||||||||||||||||||||||||||
| ※7 : 核酸医薬 | 1970年代以降、ヒトの遺伝子の研究が進展し、核酸が医薬品になるかもしれないという期待は1980年代に生まれました。しかし、当時は核酸、特にRNAを医薬に応用するための基礎的な技術が整備されておらず、しかもRNAという核酸の特性や立体構造等の学術的な理解も浅かったために、長期にわたる膨大な資金や人材の投入とは裏腹に核酸医薬の開発は実を結びませんでした。 しかし、その苦い教訓の中でも、RNAの加工技術の開発という地味な仕事がアカデミアや少数のベンチャー企業で継続されました。その結果、世界初となるアンチセンス核酸医薬(VitraveneⓇ[一般名fomivirsen],エイズ患者のサイトメガロウイルス性網膜炎用の局所投与剤)が1998年に承認され、今日、核酸は医薬品としての実用化レベルに到達しました。2013年1月には、2番目となるアンチセンス核酸医薬(KynamroⓇ[一般名Mipomersen])が遺伝性高コレステロール治療薬として承認されました。 現在、研究開発中の核酸医薬には下記の表に示すものがあり、その中で主要な核酸医薬品の作用機序について下記の図に示しています。
|
⦅主要な核酸医薬品の作用機序⦆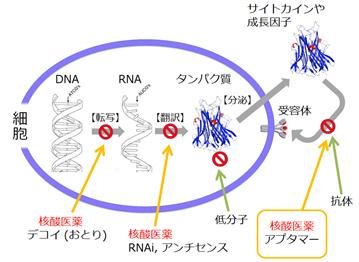 | |
| ※8 : 加齢黄斑変性症 | 加齢によって網膜の中心部にある黄斑に障害が起き、見ようとするところが見えにくくなる疾患で、進行すると失明することがあります。欧米では失明原因の第1位で、日本でも第4位の失明原因となっています。 |
| ※9 : 臨床試験 | 新薬についての製造販売承認を取得するには、ヒトでの有効性及び安全性を確認する臨床試験が不可欠です。この場合、通常、以下の3段階があります。第一段階は、少数の健常人を対象として、動物実験等により安全性の確認を終えた化合物について、その安全性や体内での動態等を確認する試験であり、第Ⅰ相試験(フェーズⅠ試験)と呼ばれています。 第一段階をクリアすると、次の段階は少数の患者(被験者)を対象として、薬効と安全性を確認する第Ⅱ相試験(フェーズⅡ試験)に入ります。この試験のステージは、通常、2ステップがとられ、最初のステップは、少数の被験者について主に薬効を確認する段階です。この試験はフェーズⅡa試験と呼ばれます。さらに被験者数を増やし、有効性と安全性のバランスを取るために最適な用量を確認するための複数の用量を設定して行うフェーズⅡb試験があります。最後の段階は、多くの被験者を対象として行う第Ⅲ相試験(フェーズⅢ試験)です。 なお、臨床試験は、承認取得の前だけでなく、承認の取得後も当局から承認の条件として実施が求められる場合があります。この時の試験は市販後臨床試験と呼ばれています。 |
| ※10 : 最適化 | 医薬品の開発過程において、in vitro 試験等によって薬効のある化合物が得られたとしても、より効果が優れ、安全性の高い化合物を得るための様々な工夫がなされます。このプロセスは最適化と呼ばれます。アプタマー医薬に関しては、長大な核酸配列の中から効果や安全性に関係のない部分をカットする短鎖化、核酸分解酵素の作用を阻止する為の化学修飾、腎臓からの早期の排出を抑えるための化合物(ポリエチレングルコールなど)との結合などがその例です。 |
| ※11 : QOL | QOL(Quality of Life)とは、患者様の日常生活の質的な水準をいいます。疼痛治療薬であれば、その痛みが無くなりまたは寛解し、それによって日常生活を普通に送れることがQOLの向上につながります。 |
| ※12 : 分子標的薬 | 生体内で疾患に関連する遺伝子やそれが係るタンパク質等(サイトカイン、成長因子等)を標的としてその活動を阻害したり活性化することを狙った医薬品をいいます。抗体医薬もアプタマー医薬も分子標的薬の一種といえます。 |
| ※13 : スクリーニング | 新薬の開発過程において、多数の化合物の中から目的とする化合物(薬効を示し安全性が高いもの)を選び出す作業のことです。 |
| ※14 : 非臨床試験、前臨床試験 | 臨床試験以外の、承認取得に必要な全ての試験を非臨床試験といい、その内容は多岐にわたります。予備毒性試験やGLP試験も非臨床試験の一つです。なお、非臨床試験の内、臨床試験開始前に行われる試験を前臨床試験といいます。 |
| ※15 : GLP試験 | GLP(Good Laboratory Practice)とは、医薬品の安全性に関する非臨床試験※14(急性毒性、亜急性毒性、慢性毒性、催奇形性、その他の毒性試験)の実施に関する試験の質を担保する基準のことをいいます。この基準は「医薬品の安全性に関する非臨床試験の実施の基準に関する省令」で定められています。なお、日本のGLPと同様な規制は欧米等でも実施されています。このGLPに準拠して行う試験をGLP試験といいます。 |
| ※16 : 予備毒性試験 | GLP試験に入る前に、的確なGLP試験を実施するためのデータ入手を目的として行う試験です。本試験で薬剤の毒性の概略を把握し、GLP試験での投与用量の設定根拠の情報を得ることができます。 |
| ※17 : ノウハウ、営業秘密 | ノウハウ(Know-How)とは「単独で又は結合して、工業目的に役立つある種の技術を完成し、またはそれを実際に応用する為に必要な秘密の技術的知識と経験、またはそれらの集積」(国際商業会議所の定義)をいい、営業秘密とは①秘密に管理されていること、②有用な情報であること、③公然と知られていないこと、の3要件を満たす技術上、営業上の情報(不正競争防止法第2条第6項の定義に基づく)のことです。 |
| ※18 : in vitro 、in vivo | In vitro (イン・ビトロ)とは、技術用語で「試験管内で」という意味です。In vitro 試験は、試験管内で、ヒトや動物のタンパク質、細胞や組織を用いて、薬物の効果や作用等を調べる試験をいいます。当社では、得られたアプタマーのタンパク質との相互作用の確認試験や細胞・組織を用いた薬効確認試験がこれに該当します。 In vivo (イン・ビボ)とは、「生体内で」という意味です。In vivo 試験とは、マウスやラット等の実験動物を用いて、生体内での薬物の作用や効果、安全性・毒性等を調べる試験をいいます。当社では、得られたアプタマーの薬効確認試験や安全性・毒性の評価試験がこれに該当します。 |
| ※19 : トランスレーショナル・リサーチ | 大学や研究機関による基礎的な医学・薬学研究の成果を疾患の治療や新薬の開発に応用するための研究をいいます。 生命科学やバイオテクノロジーの飛躍的な発展に伴い、世界的に大学での研究成果を早期に実用化に向ける動きが加速しています。薬の場合、例えば新薬の候補となる物質が大学の研究室で発見されたとしても、それをヒトでの臨床試験に繋げるには化合物の最適化(より効果があり、安全性の高いモノに改良すること)、様々な動物実験、各種試験用のサンプルの製造等、多くの課題、ハードルがあります。この基礎から臨床試験に至る一連の橋渡しのための研究がトランスレーショナル・リサーチです。 |
| ※20 : POC | POC(Proof of Concept)とは、新薬の開発段階において、ある化合物がヒトでの臨床試験(通常は少数の患者を対象としたフェーズⅡa試験)において意図した薬効と安全性の基準をクリアすることをいいます。 |
| ※21 : 病態モデル動物 | 特定の疾患の病状、例えば高血圧や肺線維等を保有すべく人為的に作成された実験動物のことです。 |
| ※22 : TGF-β (Transforming Growth Factor-β) | 線維芽細胞の形質転換を促進する因子として見出され命名されましたが、現在では、その主な作用は多くの細胞に対する増殖抑制であると言われています。また、肺や肝臓での線維化に関わる重要な因子であることが知られています。 |
| ※23 : TNF-α (Tumor Necrosis Factor-α) | 腫瘍壊死因子と訳されています。主に活性化されたマクロファージによって産生され、癌に対して出血性の壊死を生じさせるサイトカインとして発見されました。その後、炎症を誘発するタンパク質であることが知られ、その作用を阻害する抗TNF-α抗体がリウマチなどの治療に使われ、画期的な効果を上げています。 |