有価証券届出書(新規公開時)
事業内容
当社は、製薬企業の医薬品開発において受託業務を行っております。
近年、製薬企業を取り巻く事業環境は厳しくなっております。この背景として、政府の社会保障費の抑制のため、長期収載品の薬価の引き下げとジェネリック医薬品の普及促進により製薬企業の収益モデルに大きな変化が生じていることが挙げられます。また、従来の低分子化合物(*1)からバイオ医薬品(*2)に医薬品産業がシフトしたことや医薬品開発の技術革新による研究開発費の増加や、開発開始から上市に至るまでの成功率の減少により、製薬企業の研究開発生産性が大きく低下しております。
このような背景をうけて、CRO(Contract Research Organization/開発業務受託機関)と呼ばれる、医薬品開発段階での臨床試験、医薬品の製造販売後調査などに関わる業務の一部を代行、支援する企業に対して、製薬企業が行う医薬品開発をアウトソーシングするニーズが高まってきております。これによりCROは、主にモニタリング業務(*3)、データマネジメント業務(*4)、統計解析業務(*5)、安全性情報管理業務(*6)などを受託するようになり、2013年から2018年にかけて年平均成長率が8.23%となるなど、CRO業界は大きく成長を続けています。

日本CRO協会会員ベース(単位:億円)
(出所)日本CRO協会「2017年(1月~12月)年次業績報告」、「2018年(1月~12月)年次業績報告」
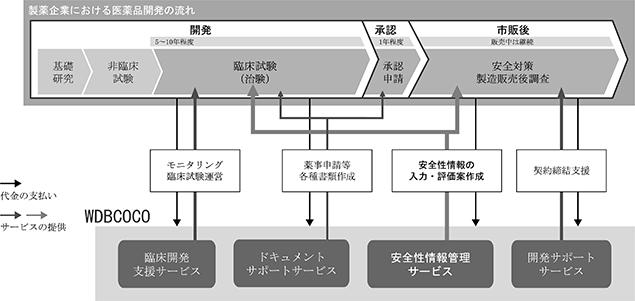
当社は、医薬品開発における代行、支援業務として「安全性情報管理サービス」を主軸に、「ドキュメントサポートサービス」、「開発サポートサービス」、「臨床開発支援サービス」を展開しております。各サービスは、委受託契約によるサービス提供のみならず、一部、人材派遣契約によるサービス提供も行っております。
なお、当社は、CRO事業の単一セグメントであるため、セグメント情報は記載せず、各サービスについて記載しております。
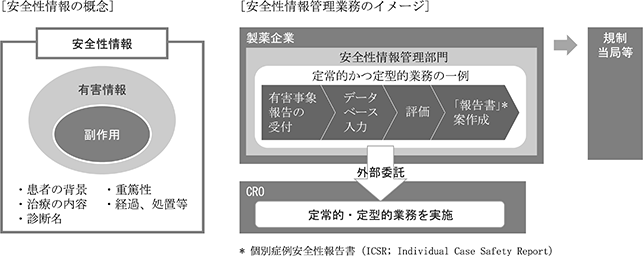
(1)安全性情報管理サービス
当サービスでは、医薬品開発における国内外の臨床試験や医薬品の市販後に発生する安全性情報について、入力・評価案作成、報告書案作成等の支援業務サービスを主軸サービスとして提供しております。
医薬品の臨床試験では、開発中の治験品を人体に投与することで、その望ましくない反応についての情報の収集、評価を行います。また、安全性が確認され上市された、優れた効能・効果を持つ医薬品であっても、様々な要因で望ましくない反応が生じる可能性があります。これらの望ましくない反応についての発現状況や有効性に関する情報(安全性情報)は、規制当局にあたる独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)への報告が製薬企業には義務付けられており、臨床試験中はもちろん、新薬としての承認を受けた後も継続的に収集・評価・報告をすることが求められております。
当社では、収集された安全性情報について、安全性情報管理データベースでの症例管理番号の発番、安全性情報の入力や、PMDAへの報告要否についての評価案作成、報告書案の作成サービスを提供しております。また、安全性情報を管理する上で発生する日英/英日翻訳や紙資料のファイリング業務も行っております。
(2)ドキュメントサポートサービス
当サービスでは、医薬品開発の各段階で発生する様々な書類やPMDAへの上市の承認申請の際に必要な資料のQC(品質保証)・翻訳からCTD(日米EU3極共通の医薬品承認申請様式)と呼ばれる承認申請書の作成までの支援業務サービスを提供しております。
(3)開発サポートサービス
当サービスでは、新薬の承認後や適応追加後に実施される製造販売後調査において、調査を依頼する医療機関との契約書類等の作成・管理代行業務、調査票の管理、調査関連文書のファイリング、コールセンター業務などのサービスを提供しております。
(4)臨床開発支援サービス
当サービスでは、製薬企業等において実施される医薬品開発のプロセスの中で、主に臨床開発におけるモニタリング業務を中心に臨床試験関連業務の支援サービスを提供しております。臨床開発では科学的な医薬品開発のため、省令や事前に定められた治験実施計画書や手順書に従って実施や記録・報告をすることが求められております。そのため、治験実施施設への電話や訪問にて、各種規程の遵守の状況を確認するとともに、迅速かつ的確な臨床開発の遂行を支援しております。
*1. 低分子化合物… 主に分子量500以下の化合物。一般的に化学合成で製造され、製薬企業が保有するライブラリーとよばれる化合物の中から、新薬候補物質の探索を行う研究が活発に行われていました。
*2. バイオ医薬品… 主に分子量が数千~15万程度で、一般的に細胞培養により製造されます。代表的なものに抗体医薬品があります。
*3. モニタリング業務… 臨床試験における主要業務であり、試験に参加する医療施設において試験実施計画書の説明、試験進捗の確認、症例報告書の回収、調査票の記入依頼、精査等を行います。
*4. データマネジメント業務… 臨床試験で回収した症例報告書のデータ入力、不整合チェック等により、統計解析を行うことができる精度の高いデータの作成、管理を行います。
*5. 統計解析業務… 症例データに対して統計処理を行うことで臨床試験の結果や生物統計の手法を使って解析し、治療薬の安全性や有効性の証明を行います。
*6. 安全性情報管理業務… 臨床試験や製造販売後において発生した症例の内容を確認し治療薬や医薬品の安全性を追跡、確認をします。
[事業系統図]
近年、製薬企業を取り巻く事業環境は厳しくなっております。この背景として、政府の社会保障費の抑制のため、長期収載品の薬価の引き下げとジェネリック医薬品の普及促進により製薬企業の収益モデルに大きな変化が生じていることが挙げられます。また、従来の低分子化合物(*1)からバイオ医薬品(*2)に医薬品産業がシフトしたことや医薬品開発の技術革新による研究開発費の増加や、開発開始から上市に至るまでの成功率の減少により、製薬企業の研究開発生産性が大きく低下しております。
このような背景をうけて、CRO(Contract Research Organization/開発業務受託機関)と呼ばれる、医薬品開発段階での臨床試験、医薬品の製造販売後調査などに関わる業務の一部を代行、支援する企業に対して、製薬企業が行う医薬品開発をアウトソーシングするニーズが高まってきております。これによりCROは、主にモニタリング業務(*3)、データマネジメント業務(*4)、統計解析業務(*5)、安全性情報管理業務(*6)などを受託するようになり、2013年から2018年にかけて年平均成長率が8.23%となるなど、CRO業界は大きく成長を続けています。

| 2013年 | 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | |
| CRO業界売上規模 | 1,228 | 1,298 | 1,449 | 1,625 | 1,777 | 1,824 |
| うち安全性情報管理市場 | 73 | 96 | 132 | 156 | 172 | 186 |
| CRO業界に占める安全性情報管理市場の規模の割合 | 5.9% | 7.4% | 9.1% | 9.6% | 9.7% | 10.2% |
日本CRO協会会員ベース(単位:億円)
(出所)日本CRO協会「2017年(1月~12月)年次業績報告」、「2018年(1月~12月)年次業績報告」
当社は、医薬品開発における代行、支援業務として「安全性情報管理サービス」を主軸に、「ドキュメントサポートサービス」、「開発サポートサービス」、「臨床開発支援サービス」を展開しております。各サービスは、委受託契約によるサービス提供のみならず、一部、人材派遣契約によるサービス提供も行っております。
なお、当社は、CRO事業の単一セグメントであるため、セグメント情報は記載せず、各サービスについて記載しております。
(1)安全性情報管理サービス
当サービスでは、医薬品開発における国内外の臨床試験や医薬品の市販後に発生する安全性情報について、入力・評価案作成、報告書案作成等の支援業務サービスを主軸サービスとして提供しております。
医薬品の臨床試験では、開発中の治験品を人体に投与することで、その望ましくない反応についての情報の収集、評価を行います。また、安全性が確認され上市された、優れた効能・効果を持つ医薬品であっても、様々な要因で望ましくない反応が生じる可能性があります。これらの望ましくない反応についての発現状況や有効性に関する情報(安全性情報)は、規制当局にあたる独立行政法人医薬品医療機器総合機構(以下「PMDA」という。)への報告が製薬企業には義務付けられており、臨床試験中はもちろん、新薬としての承認を受けた後も継続的に収集・評価・報告をすることが求められております。
当社では、収集された安全性情報について、安全性情報管理データベースでの症例管理番号の発番、安全性情報の入力や、PMDAへの報告要否についての評価案作成、報告書案の作成サービスを提供しております。また、安全性情報を管理する上で発生する日英/英日翻訳や紙資料のファイリング業務も行っております。

(2)ドキュメントサポートサービス
当サービスでは、医薬品開発の各段階で発生する様々な書類やPMDAへの上市の承認申請の際に必要な資料のQC(品質保証)・翻訳からCTD(日米EU3極共通の医薬品承認申請様式)と呼ばれる承認申請書の作成までの支援業務サービスを提供しております。
(3)開発サポートサービス
当サービスでは、新薬の承認後や適応追加後に実施される製造販売後調査において、調査を依頼する医療機関との契約書類等の作成・管理代行業務、調査票の管理、調査関連文書のファイリング、コールセンター業務などのサービスを提供しております。
(4)臨床開発支援サービス
当サービスでは、製薬企業等において実施される医薬品開発のプロセスの中で、主に臨床開発におけるモニタリング業務を中心に臨床試験関連業務の支援サービスを提供しております。臨床開発では科学的な医薬品開発のため、省令や事前に定められた治験実施計画書や手順書に従って実施や記録・報告をすることが求められております。そのため、治験実施施設への電話や訪問にて、各種規程の遵守の状況を確認するとともに、迅速かつ的確な臨床開発の遂行を支援しております。
*1. 低分子化合物… 主に分子量500以下の化合物。一般的に化学合成で製造され、製薬企業が保有するライブラリーとよばれる化合物の中から、新薬候補物質の探索を行う研究が活発に行われていました。
*2. バイオ医薬品… 主に分子量が数千~15万程度で、一般的に細胞培養により製造されます。代表的なものに抗体医薬品があります。
*3. モニタリング業務… 臨床試験における主要業務であり、試験に参加する医療施設において試験実施計画書の説明、試験進捗の確認、症例報告書の回収、調査票の記入依頼、精査等を行います。
*4. データマネジメント業務… 臨床試験で回収した症例報告書のデータ入力、不整合チェック等により、統計解析を行うことができる精度の高いデータの作成、管理を行います。
*5. 統計解析業務… 症例データに対して統計処理を行うことで臨床試験の結果や生物統計の手法を使って解析し、治療薬の安全性や有効性の証明を行います。
*6. 安全性情報管理業務… 臨床試験や製造販売後において発生した症例の内容を確認し治療薬や医薬品の安全性を追跡、確認をします。
[事業系統図]
