訂正有価証券届出書(新規公開時)
事業内容
1.当社の事業概要及び基盤技術
(1) 当社の概要
「細胞から希望をつくる」
「バイオ3Dプリンティングの技術を用いて、細胞のみから成る立体的な組織・臓器を患者さまへお届けする」
「細胞(Cyto)が融合(Fusion)する」ことを社名とする、当社『サイフューズ(Cyfuse)』は、2010年の創業以来、「革新的な三次元細胞積層技術の実用化を通じて医療の飛躍的な進歩に貢献する」という企業理念のもと、細胞のみから作製した立体的な組織・臓器を新しい「3D細胞製品」(*1)として、再生医療分野・創薬分野をはじめとする先端医療の現場へ新しい治療法の選択肢としてお届けすることで、社会に貢献することを目指す再生医療ベンチャーです。
当社は、3D細胞製品等の研究開発及び製造販売並びにこれらの付随業務の単一セグメントでありますが、当社独自の基盤技術に基づいて進める再生医療等製品の開発を中心に、以下の3つの領域で事業を展開しております。
①再生医療領域において、再生医療等製品の承認取得へ向けたパイプライン開発及び研究用細胞製品の受託
②創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発
③デバイス領域において、基盤技術を搭載した三次元細胞積層システム機器(バイオ3Dプリンタ及び消耗品)等の開発・販売及び細胞製品開発のための技術応用や新技術開発等
当社では、事業戦略に基づき、基盤技術をもとに生み出される3D細胞製品という独自の製品を複数の領域で事業展開しております。事業展開の内容につきましては、後述の「2.当社のビジネスモデル」をご参照ください。
当社の将来の収益の柱となる再生医療等製品については、現在、再生医療等製品の承認取得を目指して、末梢神経再生・骨軟骨再生・血管再生にかかる主要パイプラインの臨床開発を実施しております。
このうち、末梢神経再生のための再生医療等製品(開発コード:CYF-PA1)については、現在医師主導治験を実施中で、2023年からの企業治験開始、2025年の承認申請、2026年の承認取得を予定しております。
本医師主導治験は、2020年11月開始後、本書提出日現在において、外傷性末梢神経損傷を有する患者さまへの移植を計画通り実施し、予定した3症例の全症例への移植が終了(2022年内に全症例が経過観察期間を終了する予定)しており、安全性の確認及び有効性が推定されることから、再生医療等製品の開発プロセスに沿って承認取得に向けた臨床開発を進めております。
末梢神経再生をはじめとする開発パイプラインの詳細及び再生医療等製品の製造販売承認体制構築の状況等につきましては、後述の「3.当社の開発パイプラインとアライアンス」をご参照ください。
本製品の開発背景や概要、臨床開発の進捗については、「第21回日本再生医療学会総会」(2022年3月開催)のほか、「末梢神経」の領域の主要学会である「第33回日本末梢神経学会学術集会」(2022年9月開催)や組織工学分野の主要な国際学会である「6th world congress of the Tissue Engineering and Regenerative Medicine International Society」(TERMIS2021, 15-19 Nov開催)においても発表されております。
なお、医師主導治験後は、2023年から、当社の開発方針に基づき、多施設での臨床試験(企業治験)を2~3年の期間をかけて当社主導で実施し、企業治験実施の主たる目的である製品の普及活動、関係医療機関等との連携及び製造販売流通体制について十分に体制を整備・構築した上で、本製品の製造販売承認を取得する計画です。
また、当社では、独自の事業戦略によって、様々な企業及び医療機関等との間でのアライアンス(パートナーシップ)により、国内における再生医療等製品の製造及び販売・搬送等のサプライチェーンを構築し、将来の製品製造販売が可能な体制を確立しております。アライアンスの状況等の詳細につきましては、後述の「3.当社の開発パイプラインとアライアンス」をご参照ください。
今後は、中長期成長のため必要となる製品の実用化に向けて、主要パイプラインの臨床開発及び次世代パイプラインの研究開発等への先行投資を進めることで一時的に営業損失が膨らむものの、これらの成長資金投資の効果が再生医療等製品の上市を予定する2026年頃から現れることにより、将来的には当社の再生医療等製品の販売を通じて黒字化達成を図る事業計画です。
さらに、複数の再生医療等製品の上市に加え、様々な領域での事業展開による収益安定化及び次世代パイプラインの上市並びにパイプラインの拡大による収益拡大を達成し、再生・細胞医療分野において当社の基盤技術のポジションを確立し、将来的には、グローバル展開へ繋げていくことを計画しております。
(2) 再生医療等製品の概要
再生医療とは、細胞や組織を用いて、病気やケガなどにより機能を失った組織や臓器を修復・再生させる医療であり、患者さまに対して新たな治療法の選択肢を提供し、国民の健康増進に大きく寄与することが期待される新しい医療領域です。
本領域において、ヒト又は動物の細胞に培養等の加工を施したもので、身体の構造・機能の再建・修復・形成するものや疾病の治療・予防を目的として使用するものを総称して「再生医療等製品」といいます。

図1.再生医療等製品例
① 再生医療等製品の開発
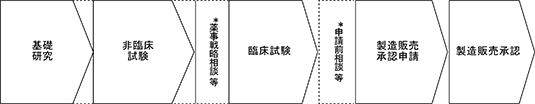
再生医療のパイプライン開発は、一般的に(Ⅰ)基礎研究の実施、(Ⅱ)非臨床試験の実施、(Ⅲ)臨床試験の実施、(Ⅳ)製造販売承認申請のプロセスで進められます。
具体的には、(Ⅰ)及び(Ⅱ)において、動物を用いた移植試験を実施し、製品の安全性と有効性を十分に確認します。また(Ⅱ)において製品の製造工程を確立させ、その後、(Ⅰ)及び(Ⅱ)のデータを持って地方厚生局や厚生労働省の承認を得た上で、(Ⅲ)の臨床試験に進みます。(Ⅲ)の臨床試験において、一定数の患者で安全性と有効性を確認後、取得したデータをもとに(Ⅳ)製造販売承認申請を行い、製造販売承認を取得することで、再生医療等製品として販売できることになります。
医薬品や医療機器の場合には、これまでに得られている数多くの知見や経験を踏まえて、設定すべき品質規格や試験、実施すべき特性解析、試験の試験項目や試験法等が整理されているのに対し、再生医療等製品の場合には、原材料が生きた細胞であるため、また製品ごとに特性が異なるため、承認までの具体的なプロセスは開発品(組織・臓器・適用)ごとに異なり、開発品ごとに独立行政法人医薬品・医療機器総合機構(以下、「PMDA」といいます。なお、PMDAとはPharmaceutical and Medical Devices Agencyの略称。)との協議・相談を重ねながら開発を進め、製品化へ向け審査され進んでいくことになります。
② 再生医療等製品開発のプロセス
再生医療等製品の研究開発のプロセスは以下のとおりであり、通常、製品化までに7年から15年程度かかるといわれております。
再生医療等製品の開発の場合、その製品の原料として、生きた細胞を用いることから、医薬品のように同一合成品を画一的に患者に投与するものとは全く異なります。
また、医薬品の開発の場合には、健常人への治験(PhaseI)を経て、段階的に大規模な治験(PhaseⅡ, PhaseⅢ)に進みますが、再生医療等製品の場合は、臨床試験入り当初から健常人ではなく実際の患者さまへの移植を行う点、症例数としては比較的小規模な臨床試験を実施する点等において、医薬品の開発プロセスと大きく異なります。そのため、再生医療等製品の開発においては、PhaseI~IIIのような相(フェーズ)は規定されておりません。
臨床試験においても、実際にヒトの身体へ移植する組織は被験者(臨床試験において移植を受ける患者さま)ごとに製造するため、医薬品のように同一合成品を大多数の被験者へ投与するような大規模な臨床試験を実施することは困難であり、製品の原料となる細胞は個体差のある不均質なものであることから、医薬品のように多数の症例数を積み上げて統計学的に厳密な評価を行うことも困難です。
従って、再生医療等製品においては、開発品の特性を踏まえ、比較的小規模な臨床試験を実施し、個々の製品のリスクとベネフィットのバランスを開発品ごとに個別に評価・審査されることで、個別具体的に製品の評価を行っていくことになります。そのため、治験実施症例数等の開発プロトコールや製品の製造販売承認までの開発プロセスについてはPMDAとの協議のもと、製品ごとに個別具体的に設定されることになります。
③ 当社の開発する再生医療等製品の特徴
従来、再生医療に用いることを目指した組織や臓器の開発では、ゲルやコラーゲンといった人工材料を用いられることが一般的でしたが、当社では人工材料を使用することなく、細胞のみで組織や臓器を作製することを可能にする独自の基盤技術を有しております。
現在、当社では「患者さまから採取した細胞のみを材料とし、バイオ3Dプリンタを使用して作製した立体的な組織・臓器を患者さまご自身の体内へ移植することで、患者さま自身の体内の組織・臓器が有する機能を回復・再生させる」という新しい治療コンセプトの再生医療等製品の開発を進めております。
当社が開発する製品は、液体での細胞を投与する製品(1D製品)やシート状に加工した細胞製品を組織や臓器に貼付する製品(2D製品)などの従来の再生医療等製品と異なるコンセプトの3D製品です。
具体的には、細胞のみから成る細胞塊(スフェロイド)及び自社で製品化した細胞版の3Dプリンタ(バイオ3Dプリンタ)を使用して立体的な組織や臓器を作製するという点に特徴と強みを有しております。
この基盤技術及びバイオ3Dプリンタを使用して細胞のみで作製された組織や臓器は、移植後の拒絶反応や感染症のリスクなどの患者さまに対する負担を軽減し、人工材料や生体材料を使用しないため高い安全性を有する点、生体との親和性も高いことから患者さまご自身の組織や臓器が持つ組織・臓器本来の機能を再生させることが可能となり医療機器等が有しない機能(再生能力)を有する点において、これまでの製品とは大きく異なる特徴を有しております。
現在、当社では、「患者さま自身の」生きた細胞を用いて、自分の細胞を自分の体内に戻す「自家細胞製品」を中心とした製品開発を進めており、主要パイプラインについては、非臨床試験(動物への移植試験)において、安全性と有効性を十分に確認し、再現性のあるデータを取得したうえで、臨床試験(患者さまへの移植試験)の段階へ開発を進めております。
また、任意の形状、立体構造の造形が可能であり、様々なサイズ(口径・長さ)の組織を作製することが可能であるというバイオ3Dプリンタの特徴を活かし、あらゆる領域の組織・臓器へ適用拡大することや同じ構造を有する組織・臓器を様々な疾患への製品として、適用拡大することも視野に入れた製品開発を行っております。
さらに、使用する細胞に制限はなく、細胞塊を作製することができるあらゆる細胞から立体的な組織・臓器を作製することが可能という基盤技術の特徴を活かし、将来的には、iPS細胞や他人の細胞を用いて立体的な組織・臓器を作製し、患者さまご自身の細胞(自家細胞)を用いて作製した立体的な組織・臓器と同種の製品として、適用拡大することも視野に入れた製品開発を行っております。
当社ではこの独自の基盤技術を用いて、ヒト細胞のみから成る移植可能な臓器を再生医療等製品として患者さまへお届けすることで、再生・細胞医療分野において、病気やケガで機能不全になった組織・臓器等に対する新しい治療法の選択肢を提供し、医療の発展に貢献することを目指しています。
現在、実用化に向け開発を進めている細胞製の神経、骨軟骨、血管のような「再生医療等製品」により、従来の治療法では困難であった組織・臓器再生という新たな治療法の選択肢が誕生することで、QOL(Quality of Life)(*2)を大きく向上させることが期待されています。
また、当社では、バイオ3Dプリンタ(「Regenova®(製品名:レジェノバ)」及び「S-PIKE®(製品名:スパイク)」による基盤技術の普及とともに、神経・骨軟骨・血管など様々な組織・臓器再生の再生医療等製品開発及び病気のメカニズムを解明する病態モデルや新薬の有効性・毒性・代謝等を評価する創薬スクリーニングツールとしての3D細胞製品の実用化も進めております。
このように、再生・細胞医療という先端医療の研究開発現場において当社の基盤技術普及が進み、国内外の研究機関において、本基盤技術を用いた研究開発が将来の細胞製品の実用化に向け加速しております。
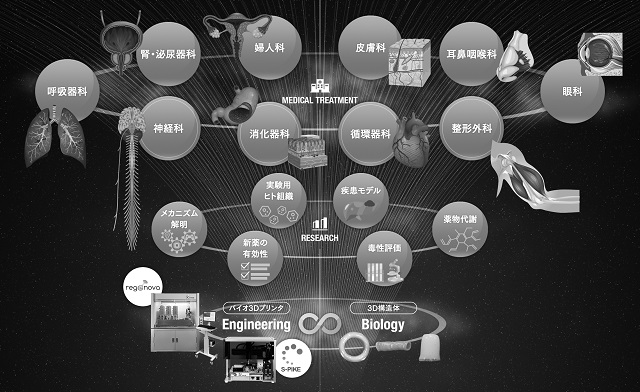
図2.バイオ3Dプリンティング技術による臓器再生の世界(イメージ)
(3) 当社の基盤技術の特徴
ヒトの細胞は水分、タンパク質、脂質などから構成されておりますが、これらの細胞成分のうち約65%が水分であることから、細胞のみで立体的な組織や臓器を作製することは困難とされておりました。
そこで、一般的に細胞から人為的に組織や臓器を作製する場合には、細胞に動物等のコラーゲンやゲル、遺伝子等の材料とを混ぜ合わせて作製することが知られており、細胞のみで実際の組織・臓器と同様の厚みや弾力性に富む構造を有する立体的な細胞構造体を作製することは困難とされていましたが、当社ではスフェロイドと呼ばれる小さな細胞の塊と剣山を使用すること、そして細胞が本来有する凝集(*3)能力に着目して生み出した独自の基盤技術を用いることで、細胞のみから厚みと弾力性を有する立体的な組織・臓器を作製することに成功しました。
当社の基盤技術は、まず細胞を増やし、数万個の細胞を凝集させ、小さなスフェロイド(細胞塊)を作製します。次に、複数の細胞塊を剣山と呼ばれる針に積み立てて(積層して)スフェロイド(細胞塊)を培養し、全体が融合したところで、針から抜き、さらに一定期間培養することで、組織としての強度や弾力性等を向上させ、移植可能な組織が完成します。
また、当社の基盤技術が搭載されたバイオ3Dプリンタは、造形にあたってデザインの自由度が高いという特徴も有しており、将来的には複雑な構造を有する組織の作製や組織の大型化にも対応することが可能です。
さらに、患者さまご自身の細胞(自家細胞)以外の、iPS由来細胞(*4)やES細胞(*5)、さらには他人の細胞(同種・他家細胞)についても、組織・臓器の作製に使用することができ、組織作製には細胞の種類による技術的な制限がないという特徴から、当社の基盤技術は、数種類の細胞を組み合わせた組織・臓器作製などへの応用可能性も有しております。
当社では、バイオロジーとエンジニアリングが融合した基盤技術を主軸とした事業展開により、再生・細胞医療分野の拡大・発展、様々な領域における研究開発促進への寄与及び従来のマーケット拡大等に加え、治療法が存在しない領域においては新たなマーケット創出に貢献することを目指してまいります。
このような当社の基盤技術は、これまでに国内外の研究機関等へのバイオ3Dプリンタの販売・設置を通じた技術普及が進んできていることから、今後、さらにこの基盤技術を基礎にした様々な製品開発が進展することにより、再生・細胞医療分野のみならずその周辺産業及び支援産業を含めた成長市場におけるあらゆる製品・サービスのプラットフォームとなる可能性があります。
<用語解説>
当社の基盤技術(三次元細胞積層技術)による組織作製のフロー
スフェロイド(細胞塊)作製
作製したい組織・臓器に応じ選択した種類の細胞を拡大培養し、一定数増やした後、数万個の細胞を専用のプレートに播種し、細胞が持つ凝集能力を利用することで、スフェロイド(細胞塊)を作製します。

図3.細胞が凝集し、スフェロイドが形成されるイメージ
積層
専用のソフトウエアにより入力した3Dデータに従ってスフェロイド(細胞塊)を「剣山」の針上に立体的に積み上げる(積層する)ことにより、目的とする組織・臓器の三次元形状を造形します。

図4.バイオ3Dプリンタに設置する「剣山」
循環培養
その後、専用容器の中で培養し、「剣山」に積層されたスフェロイド(細胞塊)が互いに融合して一体化したところで、立体的な細胞構造体が完成します。

図5.移植可能な立体的な細胞構造体
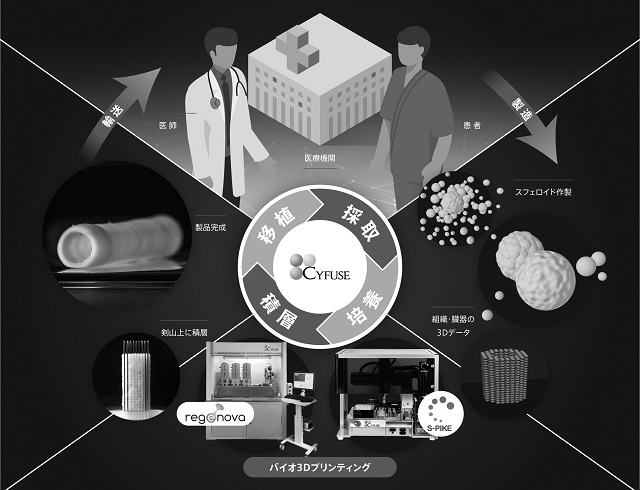
図6.バイオ3Dプリンタを用いた製造プロセス全体図
(4) 当社の基盤技術に関する知的財産(特許権等)
当社は再生・細胞医療領域という先端医療領域において、細胞製品という新規性の高い製品開発を行っている先端研究開発型ベンチャー企業であり、当社の事業展開にとって知的財産の創造・管理は極めて重要であります。
当社の知的財産の取り扱いにつきましては、中長期的な事業戦略に基づき、現状及び将来的な観点から必要となる権利の保護を進めております。
具体的には、当社事業の中核をなす細胞製品の製造方法に欠かすことのできない基盤技術については、特許権の取得による権利保護を推進し、これまでに論文発表等を介して一般に公開されている既知の情報に関しては、敢えて公知化を目的とした特許出願を通じて後に公開情報とする等、当社事業に対する権利侵害、他社による先行権利化及び技術模倣の抑止、並びに他者の後発参入への対抗策作りに努めております。
また、権利化している保有技術以外の、当社独自の培地組成や培養方法等に関する技術情報、組織・臓器作製ごとに異なって使用する機器・器具等に関する技術情報については、特許出願を通じて公開情報となった際に模倣される可能性があることから、特許出願による権利化の対象にはせず、あくまで秘匿情報としてノウハウ化を図ることで、外部への重要技術情報の流出あるいは他者による技術模倣を防ぐ知的財産権戦略をとっております。
このように、当社が保有する技術情報については、特許権等の知的財産権を取得し活用する方法及びノウハウ化し秘匿情報として管理し活用する方法とを併用する戦略を採用しております。
当社の主要な特許の具体的な内容については、以下の一覧表のとおりであり、細胞製品の製造方法に纏わる①及び②については国立大学法人九州大学が出願人であり、細胞製品の製造に必須のバイオ3Dプリンタに纏わる③及び④については当社が出願人であります。
当社は、国立大学法人九州大学の有する①及び②の特許について、第三者サブライセンス権(*6)付き独占実施・許諾権(*7)を取得しております。
当社では、独占実施権・許諾権を取得している①及び②のコア技術となる特許を細胞製品開発に関連する複数の特許等(③及び④)で補強することにより、当社の細胞製品開発に必要となる特許や技術のそれぞれが単独のものとして孤立することなく連関的に機能し、再生・細胞医療領域において優越的に事業展開できる源泉となるよう設計しております。
<用語解説>
<当社事業にかかる重要な特許>
(注1) 国立大学法人九州大学から当社へ独占ライセンスが付与されております。
(注2) 主要3か国(日米欧)とWO(国際事務局)を記載しております。欧州特許は、締約国毎ではなく欧州一括で表記しております。
2.当社のビジネスモデル
(1) ビジネスモデルの概要
当社では、従来技術・従来製品との比較優位性を背景に、世界初の革新的な「3D細胞製品」の実用化を主軸として戦略的・多面的に事業展開を進めております。当社は、3D細胞製品等の研究開発及び製造販売並びにこれらの付随業務の単一セグメントであり、①再生医療領域において、再生医療等製品の承認取得へ向けたパイプライン開発及び研究用細胞製品の受託、②創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発、③デバイス領域において、基盤技術を搭載した三次元細胞積層システム機器(バイオ3Dプリンタ及び消耗品)等の開発・販売及び細胞製品開発のための技術応用や新技術開発等を展開しております。
現在の主たる収益事業である3D細胞製品の開発委託や製造委託等の各種委託は、創薬や再生医療向けに複数の製品ラインナップを有しており、その顧客についてもアカデミアから事業会社まで幅広く、またバイオ3Dプリンタや関連消耗品のデバイス販売等も展開する等、当社では複数の収益源を有しています。
中長期的には、再生医療領域、創薬支援領域における共同開発パートナー企業からのライセンス収入、3D細胞製品の開発委託、製造委託等の各種受託及び基盤技術を搭載したデバイスの販売・レンタル等により、収益拡大を図ってまいります。
当社では、このような収益源の多様化及び収益性の向上を図ることによって、中長期成長のため必要となる製品実用化に向けて、研究開発をはじめとした先行投資によって継続的に発生する営業損失を段階的に縮減するとともに、アカデミアから事業会社まで幅広い顧客を継続的に獲得し、現在の複数の領域における事業収益を確実に成長させることで、製品上市後の収益安定化までの見通しを立てています。
(2) 当社の事業戦略
当社では、当社独自のビジネスモデルを発展拡大させ、デバイス普及により「ベース収益の確保」と「シーズ探索の拡大」を図り、創薬支援用途等の研究用組織による「早期のマネタイズ」の実現を経て、中長期的には「再生医療等製品の承認取得」を目指し、再生医療ベンチャーとしての事業価値最大化を図ってまいります。
当社独自の基盤技術を中核とした中長期的な事業展開としては、以下を想定しており、現状は、STEP2からSTEP3に移行している段階にあります。
複数の大学等の開発パートナーと共同研究を実施し、それらを通じて当社研究開発の中核となるパイプラインの構築を図ってまいります。また、バイオ3Dプリンタ「Regenova®(製品名:レジェノバ)」及び「S-PIKE®(製品名:スパイク)」の販売を通じて当社基盤技術の普及を図ってまいります。
複数の企業パートナーとの提携により、各パイプラインの製品実用化に向けた臨床開発を進めてまいります。また、細胞製品開発に必要となる基盤技術を応用した臨床用装置や将来の商業生産を想定した新技術の発明や次世代デバイスの技術開発を進めてまいります。
再生医療領域の中核パイプラインの実用化に向けた開発を進め、企業パートナーとともに再生医療等製品の承認取得を目指してまいります。また、細胞製品実用化に必要となる基盤技術の開発や新技術開発を継続し、細胞製品及びその用途の拡大を図ってまいります。さらに、当社が培ってきた基盤技術を新たな領域にも拡大するべく、次世代パイプラインの探索及び拡充を図ってまいります。
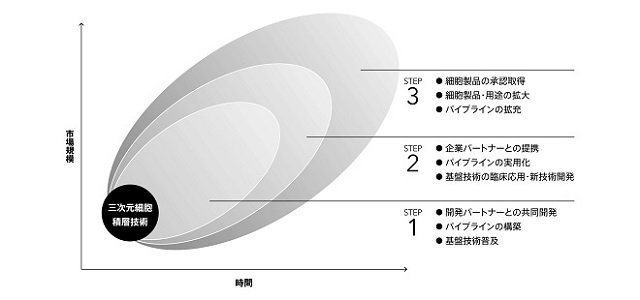
図7.中長期事業戦略(イメージ)
① 再生医療領域
当社は、再生医療領域において、神経・骨軟骨・血管など様々な組織・臓器再生の再生医療パイプライン開発を進めております。詳細は「3.当社の開発パイプラインとアライアンス」以降をご参照ください。
② 創薬支援領域
当社は、創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発を進めております。
現在の一般的な新薬開発においては、主にシャーレ上で培養されたマウス由来細胞またはヒト初代培養肝細胞(*8)を用いて新薬候補化合物の毒性試験や代謝物の評価(*9)を行いますが、その細胞が有する薬物代謝機能(*10)は2~3日で低減してしまうことから、開発現場では、より長期間機能が持続する肝臓サンプルの開発が待ち望まれています。
当社では、新薬創出の開発現場における大きな課題の1つとして挙げられる肝毒性評価(*11)系の不足に対する取り組みとして、ヒト肝臓を用いた場合と同様の毒性評価結果が得られ、高い肝機能が長期間にわたり発現する新たなツールとして、ヒト肝細胞等の細胞のみからなるヒト肝臓構造体(*12)を開発しました。
2018年9月には、3D肝臓構造体による毒性評価モデルに関する研究開発について、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の「研究開発型ベンチャー支援事業/企業間連携スタートアップに対する事業化支援」の助成事業として採択されました。
また、同じく2018年9月に、積水メディカル株式会社と共同開発を実施している肝臓構造体の創薬支援領域としての実用化を加速していくことを目的として、積水化学工業株式会社と再生・細胞医療分野における研究開発及び事業化促進に関する業務提携契約を締結するに至っております。
今後も、これまで動物試験では検出できなかったヒト特異的な毒性の検出を早期に行い、臨床試験の前にヒト肝臓で起こりうる有害事象を事前に予測することが可能なヒト肝臓構造体の開発を進め、製薬企業や非臨床試験受託会社等の創薬研究のニーズに応えるとともに、将来的には、再生医療領域への応用も視野に実際の患者さまへの移植可能な肝臓構造体の研究開発を進めてまいります。
このように、当社独自の基盤技術は、再生医療の分野での実用化のみならず、創薬支援の分野においても、新薬開発における薬剤の評価や、疾患メカニズムの解明へのニーズに対する需要、及び臨床入り後の開発リスクの低減、コスト削減や研究効率向上に多面的に貢献することが期待されています。
<用語解説>
③ デバイス領域
当社は、デバイス領域において、細胞製品開発を進展させる基礎となる基盤技術を普及させるため、バイオ3Dプリンタ等のデバイスの開発・販売とともに、細胞製品開発に必要となる技術応用や新技術開発等を進めております。
当社は、上記の①再生医療領域及び②創薬支援領域に記載する細胞製品を作製するためのデバイスとして、バイオ3Dプリンタ「Regenova®(製品名:レジェノバ)」の販売を行っております。
これらのデバイスは、専用3Dソフトウエアでスフェロイドの三次元配置を指定して3Dデータを入力し、使用する剣山とスフェロイドをセットし稼働させることで、自動的に細胞の立体積層を行うことが可能となります。
当社は、これらのデバイスの販売を行うとともに、大学等の研究機関や企業の研究所等のデバイス利用者(ユーザー)向けに立体組織の作製に関するトレーニングメニューの提供をはじめ、ユーザーの研究を継続的に支援するためのサポート、消耗品、周辺機器の提供もあわせて行っております。
また、基盤技術の技術応用により開発された、再生医療等製品の開発における臨床用三次元細胞積層システムが、各再生医療プロジェクトの臨床試験において稼働しております。
さらに、再生・細胞医療分野の研究開発促進及び基盤技術普及を拡大することを目的として、新技術方式(*13)を搭載した新型バイオ3Dプリンタ「S-PIKE®(製品名:スパイク)」を販売しております。
なお、「S-PIKE®(製品名:スパイク)」の製品販売については、シスメックス株式会社との販売提携による共同販売を行い、基盤技術の普及を進めております。
当社では、これらデバイスによる基盤技術のグローバル展開を進めることで、様々な分野・領域での共同研究や共同開発が拡大し、新たなユーザーへの技術周知やシーズの開拓、細胞製品開発が大きく促進するものと見込んでおります。
<用語解説>

図8.当社が製品化・販売するバイオ3Dプリンタ
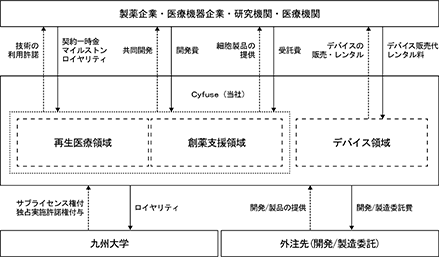
図9.当社の事業系統図
3.当社の開発パイプラインとアライアンス
(1) 当社の主要パイプラインと開発進捗状況
当社の企業成長を中長期的に牽引する再生医療等製品の開発においては、従来の再生医療等製品とは異なり、人工の足場材料を使用せずに患者さまの細胞のみで作製された再生組織・臓器を、新たな再生医療等製品として製品化することを目指して、複数のパイプライン(末梢神経再生、骨軟骨再生、血管再生等の新たな再生医療等製品の開発品ラインナップ)の臨床開発を進めております。
また、この主要パイプラインに続く次世代のパイプライン(研究開発シーズ)の探索及び拡大を進めております。
本書提出日現在での開発計画に基づく、当社のパイプラインの開発ステータスは以下のとおりです。
なお、非臨床後期の段階にあるパイプラインに開発コードを付しております。
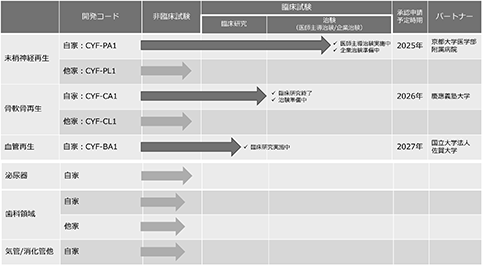
図10.当社のパイプラインの開発ステータス
末梢神経再生のための再生医療等製品(開発コード:CYF-PA1)については、現在医師主導治験を実施中で、2023年からの企業治験開始、2025年の承認申請、2026年の承認取得を予定しております。
骨・軟骨再生のための再生医療等製品(開発コード:CYF-CA1)については、現在医師主導治験の準備中で、2023年からの医師主導治験開始、2024年からの企業治験開始、2026年の承認申請、2026年内の承認取得を予定しております。
血管再生のための再生医療等製品(開発コード:CYF-BA1)については、現在臨床研究を実施中で、2023年以降の治験開始、2027年の承認申請、2027年内の承認取得を予定しております。
① 末梢神経(開発コード:CYF-PA1)
a.開発製品の概要
従来、末梢神経を損傷した患者さまには、ご自身の足から健常な神経を採取し、損傷部位に移植する自家神経移植またはシリコン製の人工神経等の移植法が採用されております。
しかしながら、自己の神経の採取には限界があり、また、採取した箇所に、しびれや痛み、麻痺が生じるなどの課題が、人工神経を移植した場合には神経の機能再生に乏しいという課題がありました。そのため、事故や腫瘍切除時に断裂損傷を受けた方々や自家神経移植が困難な方々にとっては、自己の健常な組織を犠牲にすることなく自身のQOL(Quality of Life)を大幅に向上させる新しい治療選択肢が大きく期待されています。
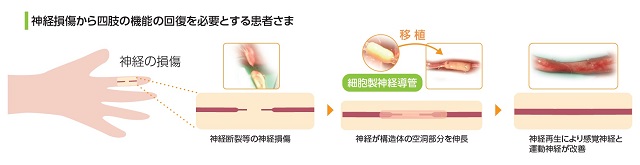
当社では、末梢神経損傷等から四肢の機能の回復を必要とされる患者さまへ、細胞製の三次元神経導管を移植することで、断裂した神経を再生し、感覚神経や運動神経が改善される新たな再生医療等製品の開発に取り組んでいます。
これまでの研究成果は「Scientific Report」「PLOS ONE」電子版「Cell Transplant」「Microsurgery」等の論文や米国科学雑誌「Newton」等に掲載され、自身の神経再生を促す新しい治療選択肢が大きく期待されています。
b.開発の進捗状況
当社が開発中の末梢神経再生のための三次元神経導管(以下、「当社製品」という。)については、独立行政法人医薬品医療機器総合機構(PMDA)へ治験届を提出し、京都大学医学部附属病院において医師主導治験(試験名称「末梢神経損傷を対象とした三次元神経導管移植による安全性と有効性を検討する医師主導治験」)(以下、「本治験」という。)を実施しております。
当社ではこれまでに京都大学医学部附属病院整形外科との共同研究において、神経損傷モデル動物を用いて三次元神経導管の有効性及び安全性を確認する非臨床試験を実施し、良好な結果を確認しました。
これらの結果をもとに、臨床試験のステージに開発を進め、末梢神経損傷患者を対象とした医師主導治験を実施しております。医師主導治験の概要は下表のとおりです。
<末梢神経損傷を対象とした三次元神経導管移植の治験概要>
本治験は、2020年11月開始後、本書提出日現在において、外傷性末梢神経損傷を有する患者さまへの移植を計画通り実施し、予定した3症例の全症例への移植が終了(2022年内に全症例が経過観察期間を終了する予定)しております。
本製品移植後、現在は治験実施計画書に基づき、定期的に経過観察及び評価(検査)が実施されております。実施されている検査としては、問診・触診等の一般診察の他、自他覚症状の確認感覚機能検査等が行われており、運動神経の回復や感覚の改善を術前と術後で比較し、確認がなされております。
その評価については、例えば、知覚及び触覚の回復度合いを、下記のようなイラスト図で示す評価方法(SW法:指針を用いた知覚テスト)を用いて評価が行われております。
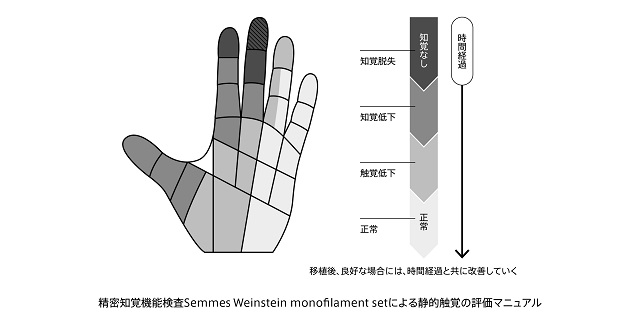
図11.知覚機能検査の評価方法例
本書提出日現在において、移植が終了した全症例について本製品に起因する有害事象や不具合の発生は報告されておらず、順調に回復の兆しが示されていることについて、報告を受けております。
本治験の進捗状況については、治験実施医療機関である京都大学医学部附属病院整形外科ホームページ(https://www.seikei.kuhp.kyoto-u.ac.jp/)において最新の情報が掲載(2022年1月に更新)されております。また、2022年3月に開催された第21回日本再生医療学会においても報告がなされました。
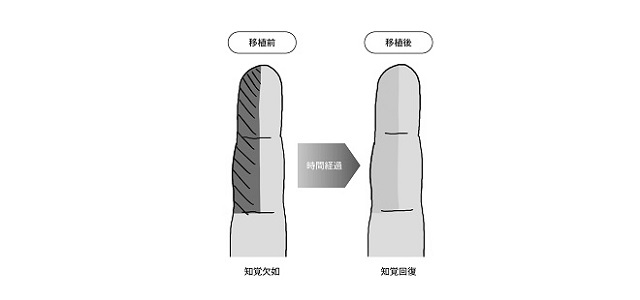
図12.本治験症例における経過観察結果(日本再生医療学会総会発表資料参照)
医師主導治験後は、当社の開発方針に基づき、2023年から当社が主導する臨床試験である企業治験を実施し、2026年に本製品の製造販売承認を取得する計画です。
具体的には、2~3年の治験実施期間において、単一ではなく複数の治験実施医療機関において、数十例の症例数の患者に対して同じ試験内容の治験を共同で実施することにより、将来の医療現場に普及する状況が再現されることになり、当社製品の普及活動、関係医療機関等との連携及び製造販売流通体制の構築がより具体化していくことになります。企業治験の実施を通じて将来の製品製造販売承認へ向け必要となる体制を着実に構築・整備について十分に体制を整備・構築した上で、本製品の製造販売承認取得後のスムーズな販売開始へつなげることが可能となる計画です。
このような医師主導治験終了後に企業治験を実施するという本開発方針については、複数のパートナー企業との共同開発体制により、製造販売体制構築を進め、将来の着実な製品販売拡大につなげるという当社独自のアライアンス戦略とも合致するものであります。
なお、本製品の製造販売体制構築の状況等については、後述の「(2)当社のアライアンス戦略」及び「(3)当社のアライアンス状況」をご参照ください。
また、本医師主導治験の今後の進捗や結果の公表については、2022年内に現在経過観察期間中の3症例目を含めた全症例の経過観察期間終了後に、開発主体である医療機関側(京都大学医学部附属病院)において、本治験全症例に関する結果を取り纏めた統括報告書完成後の2023年中の発表を予定しております。
c.医師主導治験等の情報に関する開示等の方針
臨床試験に関する被験者の個別データについては、治験実施医療機関である京都大学医学部附属病院において、本製品移植後から経過観察をスタートし、移植4週目以降より、知覚検査等により本製品の移植による神経機能の改善が見られるか否かについて、定期的な検査が実施され、取得・管理されております。
なお、本治験における全実施症例が3例と極めて少数であるという特性上、被験者である患者さまの個人情報保護の観点から、移植部位の状況や損傷部位の回復の程度等の個別の症例に関する情報については、極めて慎重に取り扱われることになります。
また、本製品のような新規性の高い製品については、製品開発とは別に将来、本治験による成果を研究開発成果として治験実施責任医師による知的財産権化(特許等の申請等)する可能性があることから、当社の事業活動によってこれらの研究開発活動を阻害することがないよう、治験実施責任医師と連携して情報公開の対象・範囲・内容を設定しております。
以上のような事情に鑑み、当社では、臨床試験に関する情報の開示については、被験者である患者さまの個人情報保護の観点、治験実施医療機関における情報管理の観点、及び治験実施責任医師の研究開発活動における情報保護等の観点を複合的かつ最大限に考慮してまいる方針です。
本方針を踏まえ、定期的に開催されている学会等での発表を主たる情報開示とし、これに加え、試験進捗に応じて公開される抄録や論文等、実施医療機関から公開可能情報が出てきた段階で、かつ、上記3つの情報保護の観点に十分に配慮するかたちで適時適切に情報開示を行ってまいります。
また、当社では、上記原則に則りつつ、投資家の皆様への情報開示の重要性に鑑み、引き続き、実施医療機関との協議や被験者様の同意取得、治験実施医療機関の倫理委員会及び広報部における承認を得た場合には、適時適切に情報開示を行ってまいります。
当社では、今後も、当社が関与する臨床試験については医療機関と連携しながら、適時適切なタイミングで学会発表や論文公開等を通じて進捗報告や結果について公表してまいります。
② 骨・軟骨(開発コード:CYF-CA1)
a.開発製品の概要
関節の軟骨は血管が通っていないことから自己再生能力が極めて乏しく、一旦損傷すると再生することなく欠損が進行して重度化しやすい部位です。
従来の軟骨再生製品は、関節表面の薄い軟骨層の損傷のみを対象としており、軟骨層を支える軟骨下骨の層まで損傷が及ぶ場合には、人工関節への置換または経過観察による対処療法が選択されていました。
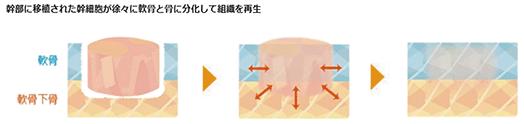
当社は、患者さま自身の間葉系幹細胞(*14)から当社の基盤技術によって細胞製の骨軟骨構造体(高密度スキャフォールドフリー脂肪由来幹細胞構造体:HDMAC(High Density Mesenchymal stem cell scaffold free Autologous Construct (HDMAC) )を作製し、骨軟骨の欠損部へ移植するという新たな治療法の開発を進めております。
この人工の足場材料を使用せずに作製した細胞製の骨軟骨構造体を欠損部へ移植することで、細胞自らが徐々に軟骨と骨に分化して、軟骨及び軟骨層を支える軟骨下骨それぞれの組織を再生することが確認されており、これまで効果的な治療法に乏しかった患者のQOL(Quality of Life)の向上に向けて大きな期待が寄せられています。これまでの研究成果は「Journal of Orthopaedic Surgery」等に掲載されています。

b.開発の進捗状況
これまでに九州大学病院において、変形性膝関節症をはじめとする患者さまへ細胞製骨軟骨を移植する製品開発を目指した臨床試験(プロジェクト名:「高密度スキャフォールドフリー脂肪由来幹細胞構造体(以下、「HDMAC」といいます。)を用いた骨軟骨組織再生の臨床研究」)を、国立研究開発法人日本医療研究開発機構(以下、「AMED」という。)による支援を受け実施し、全症例の移植を完了し、主要評価項目である安全性評価を達成し、ヒトでのPOC(Proof of concept)を取得致しました。現在、慶應義塾大学とともに早期の次相臨床試験開始に向け準備を継続しております。
当社の細胞製の骨軟骨構造体は、軟骨と軟骨下骨とを同時に再生させることが可能な新規の細胞製品であり、これまで効果的な治療法に乏しかった患者さまのQOL(Quality of Life)の向上に向けて期待が寄せられています。
今後は、この骨軟骨再生の開発をさらに進めるため、現在、慶應義塾大学と共に次相の臨床試験の開始に向け開発を進めており、これまで困難とされてきた関節硝子軟骨(*15)の再生と、さらには骨と軟骨の同時再生という治療方法で多くの患者さまに貢献することを目指してまいります。
<用語解説>
③ 血管(開発コード:CYF-BA1)
a.開発製品の概要
現在、腎不全等により血液透析を必要とされる患者さまの多くは、自己血管内シャント(*16)や人工血管を使用したバスキュラーアクセス(*17)法により治療されています。
しかしながら、従来の自己血管を用いた治療では、血管の採取に限界があり、また、人工血管では感染症や狭窄が生じてしまうことなどの課題がありました。
当社は、AMEDの支援を受け、「立体造形による機能的な生体組織製造技術の開発/細胞を用いた機能的な立体組織作成技術の研究開発」において、国立大学法人佐賀大学と共同で、細胞のみで作製した小口径細胞製血管(*18)の開発を進めてまいりました。

b.開発の進捗状況
本細胞製血管については、これまでにウサギやミニブタでの非臨床試験を実施し、非臨床POC(Proof of concept)を取得いたしました。本成果については、「Nature communications」に掲載されております。
これまでに、国立大学法人佐賀大学と共同で進めるAMED委託事業「バイオ3Dプリンタを用いて造形した小口径Scaffold free細胞人工血管の臨床研究」において臨床開発を進めております。
今後は、感染症に強く、高い弾力性を有する細胞製血管の開発をさらに進め、糖尿病をはじめとする血管障害を抱えている透析患者さまへ新たな治療の選択肢の提供をし、将来的には重症下肢虚血(*19)の血行再建や冠動脈バイパス術(*20)、脳血管・小児用血管等の領域への適用拡大を目指してまいります。
さらに将来的には、この細胞のみから作製された管状の細胞構造体による機能再建の技術が発展することにより、消化器、泌尿器等のような血管以外の管状構造を有する領域での適応拡大についても展望しております。
<用語解説>
(2) 当社のアライアンス戦略
当社では、従来技術・従来製品との比較優位性を背景に、創薬系ベンチャーとは異なる事業戦略に基づき、世界初の革新的な再生医療等製品の実用化を主軸として戦略的・多面的に事業展開を進めております。
当社が開発を進める再生医療等製品においては、医薬品と異なり、個体差のある材料である細胞の採取から培養、最終製品の出荷、輸送、患者への移植までの製品が届くステップが個別具体的なものとなるのが特徴です。
そのため、製品開発プロセスにおいても、単一の化合物についてのライセンスを保有するバイオベンチャー1社の企業が単独で、アウトソーシングやライセンスアウトに依存しながら開発を進めていく一般的な創薬系ベンチャーでの医薬品の開発(ライセンスアウトした企業自体に開発力が乏しい場合であっても医薬品の製品化自体は可能)と異なり、再生医療等製品の製品化にあたっては、企業や医療機関との連携や技術・設備・装置等の共同開発体制構築が必要不可欠といえます。
また、医薬品におけるアライアンスは、ライセンスの権利付与を前提とするのに対して、再生医療におけるアライアンスは、単なる権利移転のみならず、製品製造にかかる技術やノウハウ等の移管を要することから、当社では、将来の製造販売体制構築を視野に入れた共同開発体制を構築する独自のアライアンス戦略をとっています。
そして着実に開発を進めるため、製造設備等のインフラに関する技術やノウハウ・設備等を有する複数の医療機関・事業会社・行政機関等の外部パートナーとの共同開発体制(コンソーシアム)を形成することで、開発を加速させております。
このような当社独自のアライアンス戦略は、①1社単独による開発リスクを低減し、事業化パートナー企業と有機的に連携することにより、着実に製品化へ向けた確度の高い開発を進め、開発製品の上市の確度が大きく向上するとともに、②実用化に近いパイプラインを複数有し、かつ、製品ごとにターゲットマーケット及び販売戦略をすみ分けることで、事業リスクを低減し、事業計画実現の確度を高めるものです。
再生・細胞医療分野において世界初の製品上市により事業計画を実現することを目指す当社にあっては、その独自のアライアンス戦略に基づき、確実な最終製品化のためにライセンスパートナーへの技術移管を含めた製造販売体制を構築することが、結果として当社の製品のライセンスの価値を高め、ひいては当社の事業価値を増加していくものと考えております。
したがって、当社の再生医療等製品の上市の蓋然性については、実際の共同開発体制や開発パートナーの開発力・技術力が重要な判断指標となります。双方が保有する技術・ノウハウをハイブリッドさせることで、当社製品が安定的に供給できる体制になること、及び双方の技術を補完することで新たな市場を共に開拓していくことができるポテンシャルを有していることを合意の上、患者さまに新しい治療法の選択肢を安心安全にお届けする体制を構築していく方針です。
後述の「(3)当社のアライアンスの状況」に記載のとおり、当社では、すべての主要パイプラインについて、開発・製造・販売までを、専門性が高い開発力・技術力を有する複数の開発パートナーが有機的に連携し担うサプライチェーン構築が進んでおり、これにより、製品化についての蓋然性が高まっております。
具体的には、本書提出日現在、岩谷産業株式会社、太陽ホールディングス株式会社、日立グローバルライフソリューションズ株式会社、福岡地所株式会社、藤森工業株式会社及び株式会社メディパルホールディングス等の事業会社との業務提携等により、商業化を見据えた開発が大きく進んでおります。
今後は、このコンソーシアムを基盤として、製品の原材料である細胞の調達から製品製造、販売まで一気通貫で実施可能なサプライチェーンを構築し、将来の再生医療等製品の販売や顧客獲得拡大を図ってまいります。
(3) 当社のアライアンス状況
当社では現在、現在までに締結したパートナーシップにより、国内における製品の製造及び販売・搬送等のサプライチェーンの核となる部分についてはすでにサプライチェーンを確立しております。
具体的には、提携パートナー企業である太陽ホールディングス株式会社との間において業務提携契約を締結し、この当社独自の製品製造にかかる技術やノウハウ等の移管を含めたアライアンスに基づき、将来の当社製品の製造・販売体制構築へ向かって共同で事業化を進めてまいりました。
当社再生医療等製品の製造・販売体制の構築及び事業化に関する業務提携・製造施設の構築に関する業務提携をもとに、当社製品の臨床開発と並行して、太陽ホールディングス株式会社の子会社である太陽ファルマテック株式会社への製品製造技術移管を進め、2021年9月末に同社の高槻工場内に当社製品を製造することが可能な施設が竣工しました。
また、本施設には2020年7月に業務提携契約を締結した日立グローバルライフソリューションズ株式会社との間で共同開発した、コンパクトかつシームレスな製造設備を導入しており、共同開発成果を実用化する形で、製造施設の完成に至っております。本施設及び本体制においては、当社の開発する様々な種類の製品がその対象となる可能性があり、これにより当社においては、自社で製造方法が確立され、量産化に向けた見通しがある状況にあります。
さらに、2021年12月には、再生医療等製品の安定的な流通販売体制を構築することを目的として、株式会社メディパルホールディングスとの間で「再生医療等製品の実用化へ向けた開発投資契約」を締結し、同社が開発を進める再生医療等製品を医療機関へ提供するサプライチェーンの構築及びより一層の製造販売体制強化が実現しております。
これに加えて、当社では、すでに当社が形成している整形外科領域を中心とする医療機関等との連携を軸として、医薬品とは異なる再生医療等製品独自の販売ルートを確保している状況にあり、さらに今後の提携パートナー企業との連携による販売ルート拡大も見込まれます。
今後は、現状の国内での体制構築に加え、グローバルでの事業展開を視野に入れ、海外進出のためのさらなるサプライチェーンの拡大や海外の現地企業、研究機関及び医療機関等との連携に基づく海外におけるサプライチェーンの構築等を強化していく方針です。

(1) 当社の概要
「細胞から希望をつくる」
「バイオ3Dプリンティングの技術を用いて、細胞のみから成る立体的な組織・臓器を患者さまへお届けする」
「細胞(Cyto)が融合(Fusion)する」ことを社名とする、当社『サイフューズ(Cyfuse)』は、2010年の創業以来、「革新的な三次元細胞積層技術の実用化を通じて医療の飛躍的な進歩に貢献する」という企業理念のもと、細胞のみから作製した立体的な組織・臓器を新しい「3D細胞製品」(*1)として、再生医療分野・創薬分野をはじめとする先端医療の現場へ新しい治療法の選択肢としてお届けすることで、社会に貢献することを目指す再生医療ベンチャーです。
当社は、3D細胞製品等の研究開発及び製造販売並びにこれらの付随業務の単一セグメントでありますが、当社独自の基盤技術に基づいて進める再生医療等製品の開発を中心に、以下の3つの領域で事業を展開しております。
①再生医療領域において、再生医療等製品の承認取得へ向けたパイプライン開発及び研究用細胞製品の受託
②創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発
③デバイス領域において、基盤技術を搭載した三次元細胞積層システム機器(バイオ3Dプリンタ及び消耗品)等の開発・販売及び細胞製品開発のための技術応用や新技術開発等
当社では、事業戦略に基づき、基盤技術をもとに生み出される3D細胞製品という独自の製品を複数の領域で事業展開しております。事業展開の内容につきましては、後述の「2.当社のビジネスモデル」をご参照ください。
当社の将来の収益の柱となる再生医療等製品については、現在、再生医療等製品の承認取得を目指して、末梢神経再生・骨軟骨再生・血管再生にかかる主要パイプラインの臨床開発を実施しております。
このうち、末梢神経再生のための再生医療等製品(開発コード:CYF-PA1)については、現在医師主導治験を実施中で、2023年からの企業治験開始、2025年の承認申請、2026年の承認取得を予定しております。
本医師主導治験は、2020年11月開始後、本書提出日現在において、外傷性末梢神経損傷を有する患者さまへの移植を計画通り実施し、予定した3症例の全症例への移植が終了(2022年内に全症例が経過観察期間を終了する予定)しており、安全性の確認及び有効性が推定されることから、再生医療等製品の開発プロセスに沿って承認取得に向けた臨床開発を進めております。
末梢神経再生をはじめとする開発パイプラインの詳細及び再生医療等製品の製造販売承認体制構築の状況等につきましては、後述の「3.当社の開発パイプラインとアライアンス」をご参照ください。
本製品の開発背景や概要、臨床開発の進捗については、「第21回日本再生医療学会総会」(2022年3月開催)のほか、「末梢神経」の領域の主要学会である「第33回日本末梢神経学会学術集会」(2022年9月開催)や組織工学分野の主要な国際学会である「6th world congress of the Tissue Engineering and Regenerative Medicine International Society」(TERMIS2021, 15-19 Nov開催)においても発表されております。
なお、医師主導治験後は、2023年から、当社の開発方針に基づき、多施設での臨床試験(企業治験)を2~3年の期間をかけて当社主導で実施し、企業治験実施の主たる目的である製品の普及活動、関係医療機関等との連携及び製造販売流通体制について十分に体制を整備・構築した上で、本製品の製造販売承認を取得する計画です。
また、当社では、独自の事業戦略によって、様々な企業及び医療機関等との間でのアライアンス(パートナーシップ)により、国内における再生医療等製品の製造及び販売・搬送等のサプライチェーンを構築し、将来の製品製造販売が可能な体制を確立しております。アライアンスの状況等の詳細につきましては、後述の「3.当社の開発パイプラインとアライアンス」をご参照ください。
今後は、中長期成長のため必要となる製品の実用化に向けて、主要パイプラインの臨床開発及び次世代パイプラインの研究開発等への先行投資を進めることで一時的に営業損失が膨らむものの、これらの成長資金投資の効果が再生医療等製品の上市を予定する2026年頃から現れることにより、将来的には当社の再生医療等製品の販売を通じて黒字化達成を図る事業計画です。
さらに、複数の再生医療等製品の上市に加え、様々な領域での事業展開による収益安定化及び次世代パイプラインの上市並びにパイプラインの拡大による収益拡大を達成し、再生・細胞医療分野において当社の基盤技術のポジションを確立し、将来的には、グローバル展開へ繋げていくことを計画しております。
(2) 再生医療等製品の概要
再生医療とは、細胞や組織を用いて、病気やケガなどにより機能を失った組織や臓器を修復・再生させる医療であり、患者さまに対して新たな治療法の選択肢を提供し、国民の健康増進に大きく寄与することが期待される新しい医療領域です。
本領域において、ヒト又は動物の細胞に培養等の加工を施したもので、身体の構造・機能の再建・修復・形成するものや疾病の治療・予防を目的として使用するものを総称して「再生医療等製品」といいます。

図1.再生医療等製品例
① 再生医療等製品の開発
再生医療のパイプライン開発は、一般的に(Ⅰ)基礎研究の実施、(Ⅱ)非臨床試験の実施、(Ⅲ)臨床試験の実施、(Ⅳ)製造販売承認申請のプロセスで進められます。
具体的には、(Ⅰ)及び(Ⅱ)において、動物を用いた移植試験を実施し、製品の安全性と有効性を十分に確認します。また(Ⅱ)において製品の製造工程を確立させ、その後、(Ⅰ)及び(Ⅱ)のデータを持って地方厚生局や厚生労働省の承認を得た上で、(Ⅲ)の臨床試験に進みます。(Ⅲ)の臨床試験において、一定数の患者で安全性と有効性を確認後、取得したデータをもとに(Ⅳ)製造販売承認申請を行い、製造販売承認を取得することで、再生医療等製品として販売できることになります。
医薬品や医療機器の場合には、これまでに得られている数多くの知見や経験を踏まえて、設定すべき品質規格や試験、実施すべき特性解析、試験の試験項目や試験法等が整理されているのに対し、再生医療等製品の場合には、原材料が生きた細胞であるため、また製品ごとに特性が異なるため、承認までの具体的なプロセスは開発品(組織・臓器・適用)ごとに異なり、開発品ごとに独立行政法人医薬品・医療機器総合機構(以下、「PMDA」といいます。なお、PMDAとはPharmaceutical and Medical Devices Agencyの略称。)との協議・相談を重ねながら開発を進め、製品化へ向け審査され進んでいくことになります。
② 再生医療等製品開発のプロセス
再生医療等製品の研究開発のプロセスは以下のとおりであり、通常、製品化までに7年から15年程度かかるといわれております。

| プロセス | 期間 (目安) | 主な内容 |
| 基礎研究 | 2~3年 | 開発候補品を探索するための研究開発 |
| 非臨床試験 | 3~5年 | 実験動物等への移植を実施し、安全性及び有効性等を確認する試験 |
| 臨床試験 | 3~7年 | 患者さまへの移植を実施し、安全性及び有効性等を確認する試験 |
| 製造販売承認申請 | 1年 | 再生医療等製品の製造販売承認取得へ向けたPMDAによる審査 |
再生医療等製品の開発の場合、その製品の原料として、生きた細胞を用いることから、医薬品のように同一合成品を画一的に患者に投与するものとは全く異なります。
また、医薬品の開発の場合には、健常人への治験(PhaseI)を経て、段階的に大規模な治験(PhaseⅡ, PhaseⅢ)に進みますが、再生医療等製品の場合は、臨床試験入り当初から健常人ではなく実際の患者さまへの移植を行う点、症例数としては比較的小規模な臨床試験を実施する点等において、医薬品の開発プロセスと大きく異なります。そのため、再生医療等製品の開発においては、PhaseI~IIIのような相(フェーズ)は規定されておりません。
臨床試験においても、実際にヒトの身体へ移植する組織は被験者(臨床試験において移植を受ける患者さま)ごとに製造するため、医薬品のように同一合成品を大多数の被験者へ投与するような大規模な臨床試験を実施することは困難であり、製品の原料となる細胞は個体差のある不均質なものであることから、医薬品のように多数の症例数を積み上げて統計学的に厳密な評価を行うことも困難です。
従って、再生医療等製品においては、開発品の特性を踏まえ、比較的小規模な臨床試験を実施し、個々の製品のリスクとベネフィットのバランスを開発品ごとに個別に評価・審査されることで、個別具体的に製品の評価を行っていくことになります。そのため、治験実施症例数等の開発プロトコールや製品の製造販売承認までの開発プロセスについてはPMDAとの協議のもと、製品ごとに個別具体的に設定されることになります。
③ 当社の開発する再生医療等製品の特徴
従来、再生医療に用いることを目指した組織や臓器の開発では、ゲルやコラーゲンといった人工材料を用いられることが一般的でしたが、当社では人工材料を使用することなく、細胞のみで組織や臓器を作製することを可能にする独自の基盤技術を有しております。
現在、当社では「患者さまから採取した細胞のみを材料とし、バイオ3Dプリンタを使用して作製した立体的な組織・臓器を患者さまご自身の体内へ移植することで、患者さま自身の体内の組織・臓器が有する機能を回復・再生させる」という新しい治療コンセプトの再生医療等製品の開発を進めております。
当社が開発する製品は、液体での細胞を投与する製品(1D製品)やシート状に加工した細胞製品を組織や臓器に貼付する製品(2D製品)などの従来の再生医療等製品と異なるコンセプトの3D製品です。
具体的には、細胞のみから成る細胞塊(スフェロイド)及び自社で製品化した細胞版の3Dプリンタ(バイオ3Dプリンタ)を使用して立体的な組織や臓器を作製するという点に特徴と強みを有しております。
この基盤技術及びバイオ3Dプリンタを使用して細胞のみで作製された組織や臓器は、移植後の拒絶反応や感染症のリスクなどの患者さまに対する負担を軽減し、人工材料や生体材料を使用しないため高い安全性を有する点、生体との親和性も高いことから患者さまご自身の組織や臓器が持つ組織・臓器本来の機能を再生させることが可能となり医療機器等が有しない機能(再生能力)を有する点において、これまでの製品とは大きく異なる特徴を有しております。
現在、当社では、「患者さま自身の」生きた細胞を用いて、自分の細胞を自分の体内に戻す「自家細胞製品」を中心とした製品開発を進めており、主要パイプラインについては、非臨床試験(動物への移植試験)において、安全性と有効性を十分に確認し、再現性のあるデータを取得したうえで、臨床試験(患者さまへの移植試験)の段階へ開発を進めております。
また、任意の形状、立体構造の造形が可能であり、様々なサイズ(口径・長さ)の組織を作製することが可能であるというバイオ3Dプリンタの特徴を活かし、あらゆる領域の組織・臓器へ適用拡大することや同じ構造を有する組織・臓器を様々な疾患への製品として、適用拡大することも視野に入れた製品開発を行っております。
さらに、使用する細胞に制限はなく、細胞塊を作製することができるあらゆる細胞から立体的な組織・臓器を作製することが可能という基盤技術の特徴を活かし、将来的には、iPS細胞や他人の細胞を用いて立体的な組織・臓器を作製し、患者さまご自身の細胞(自家細胞)を用いて作製した立体的な組織・臓器と同種の製品として、適用拡大することも視野に入れた製品開発を行っております。
当社ではこの独自の基盤技術を用いて、ヒト細胞のみから成る移植可能な臓器を再生医療等製品として患者さまへお届けすることで、再生・細胞医療分野において、病気やケガで機能不全になった組織・臓器等に対する新しい治療法の選択肢を提供し、医療の発展に貢献することを目指しています。
現在、実用化に向け開発を進めている細胞製の神経、骨軟骨、血管のような「再生医療等製品」により、従来の治療法では困難であった組織・臓器再生という新たな治療法の選択肢が誕生することで、QOL(Quality of Life)(*2)を大きく向上させることが期待されています。
また、当社では、バイオ3Dプリンタ(「Regenova®(製品名:レジェノバ)」及び「S-PIKE®(製品名:スパイク)」による基盤技術の普及とともに、神経・骨軟骨・血管など様々な組織・臓器再生の再生医療等製品開発及び病気のメカニズムを解明する病態モデルや新薬の有効性・毒性・代謝等を評価する創薬スクリーニングツールとしての3D細胞製品の実用化も進めております。
このように、再生・細胞医療という先端医療の研究開発現場において当社の基盤技術普及が進み、国内外の研究機関において、本基盤技術を用いた研究開発が将来の細胞製品の実用化に向け加速しております。

図2.バイオ3Dプリンティング技術による臓器再生の世界(イメージ)
| *1 | 3D細胞製品 | 再生医療等製品としての組織・臓器や研究開発の現場で用いる立体的な組織・細胞構造体等、ヒト細胞から作製される「細胞製品」の総称 |
| *2 | QOL(Quality of Life) | 生活・生命の質。転じて、患者さまの治療中及び治療後の日常的な生活の充実度や満足度 |
(3) 当社の基盤技術の特徴
ヒトの細胞は水分、タンパク質、脂質などから構成されておりますが、これらの細胞成分のうち約65%が水分であることから、細胞のみで立体的な組織や臓器を作製することは困難とされておりました。
そこで、一般的に細胞から人為的に組織や臓器を作製する場合には、細胞に動物等のコラーゲンやゲル、遺伝子等の材料とを混ぜ合わせて作製することが知られており、細胞のみで実際の組織・臓器と同様の厚みや弾力性に富む構造を有する立体的な細胞構造体を作製することは困難とされていましたが、当社ではスフェロイドと呼ばれる小さな細胞の塊と剣山を使用すること、そして細胞が本来有する凝集(*3)能力に着目して生み出した独自の基盤技術を用いることで、細胞のみから厚みと弾力性を有する立体的な組織・臓器を作製することに成功しました。
当社の基盤技術は、まず細胞を増やし、数万個の細胞を凝集させ、小さなスフェロイド(細胞塊)を作製します。次に、複数の細胞塊を剣山と呼ばれる針に積み立てて(積層して)スフェロイド(細胞塊)を培養し、全体が融合したところで、針から抜き、さらに一定期間培養することで、組織としての強度や弾力性等を向上させ、移植可能な組織が完成します。
また、当社の基盤技術が搭載されたバイオ3Dプリンタは、造形にあたってデザインの自由度が高いという特徴も有しており、将来的には複雑な構造を有する組織の作製や組織の大型化にも対応することが可能です。
さらに、患者さまご自身の細胞(自家細胞)以外の、iPS由来細胞(*4)やES細胞(*5)、さらには他人の細胞(同種・他家細胞)についても、組織・臓器の作製に使用することができ、組織作製には細胞の種類による技術的な制限がないという特徴から、当社の基盤技術は、数種類の細胞を組み合わせた組織・臓器作製などへの応用可能性も有しております。
当社では、バイオロジーとエンジニアリングが融合した基盤技術を主軸とした事業展開により、再生・細胞医療分野の拡大・発展、様々な領域における研究開発促進への寄与及び従来のマーケット拡大等に加え、治療法が存在しない領域においては新たなマーケット創出に貢献することを目指してまいります。
このような当社の基盤技術は、これまでに国内外の研究機関等へのバイオ3Dプリンタの販売・設置を通じた技術普及が進んできていることから、今後、さらにこの基盤技術を基礎にした様々な製品開発が進展することにより、再生・細胞医療分野のみならずその周辺産業及び支援産業を含めた成長市場におけるあらゆる製品・サービスのプラットフォームとなる可能性があります。
<用語解説>
| *3 | 凝集 | 似たような細胞は細胞間の接着因子により集まるという細胞凝集現象に基づく、細胞が一つに集まり固まる現象 |
| *4 | iPS由来細胞 | iPS細胞(人工多能性幹細胞)から作られた細胞 |
| *5 | ES細胞 | 胚性幹細胞。人の受精卵(胚)から作られ、様々な臓器や組織に分化することが可能となる細胞 |
当社の基盤技術(三次元細胞積層技術)による組織作製のフロー
作製したい組織・臓器に応じ選択した種類の細胞を拡大培養し、一定数増やした後、数万個の細胞を専用のプレートに播種し、細胞が持つ凝集能力を利用することで、スフェロイド(細胞塊)を作製します。

図3.細胞が凝集し、スフェロイドが形成されるイメージ
専用のソフトウエアにより入力した3Dデータに従ってスフェロイド(細胞塊)を「剣山」の針上に立体的に積み上げる(積層する)ことにより、目的とする組織・臓器の三次元形状を造形します。

図4.バイオ3Dプリンタに設置する「剣山」
その後、専用容器の中で培養し、「剣山」に積層されたスフェロイド(細胞塊)が互いに融合して一体化したところで、立体的な細胞構造体が完成します。

図5.移植可能な立体的な細胞構造体

図6.バイオ3Dプリンタを用いた製造プロセス全体図
(4) 当社の基盤技術に関する知的財産(特許権等)
当社は再生・細胞医療領域という先端医療領域において、細胞製品という新規性の高い製品開発を行っている先端研究開発型ベンチャー企業であり、当社の事業展開にとって知的財産の創造・管理は極めて重要であります。
当社の知的財産の取り扱いにつきましては、中長期的な事業戦略に基づき、現状及び将来的な観点から必要となる権利の保護を進めております。
具体的には、当社事業の中核をなす細胞製品の製造方法に欠かすことのできない基盤技術については、特許権の取得による権利保護を推進し、これまでに論文発表等を介して一般に公開されている既知の情報に関しては、敢えて公知化を目的とした特許出願を通じて後に公開情報とする等、当社事業に対する権利侵害、他社による先行権利化及び技術模倣の抑止、並びに他者の後発参入への対抗策作りに努めております。
また、権利化している保有技術以外の、当社独自の培地組成や培養方法等に関する技術情報、組織・臓器作製ごとに異なって使用する機器・器具等に関する技術情報については、特許出願を通じて公開情報となった際に模倣される可能性があることから、特許出願による権利化の対象にはせず、あくまで秘匿情報としてノウハウ化を図ることで、外部への重要技術情報の流出あるいは他者による技術模倣を防ぐ知的財産権戦略をとっております。
このように、当社が保有する技術情報については、特許権等の知的財産権を取得し活用する方法及びノウハウ化し秘匿情報として管理し活用する方法とを併用する戦略を採用しております。
当社の主要な特許の具体的な内容については、以下の一覧表のとおりであり、細胞製品の製造方法に纏わる①及び②については国立大学法人九州大学が出願人であり、細胞製品の製造に必須のバイオ3Dプリンタに纏わる③及び④については当社が出願人であります。
当社は、国立大学法人九州大学の有する①及び②の特許について、第三者サブライセンス権(*6)付き独占実施・許諾権(*7)を取得しております。
当社では、独占実施権・許諾権を取得している①及び②のコア技術となる特許を細胞製品開発に関連する複数の特許等(③及び④)で補強することにより、当社の細胞製品開発に必要となる特許や技術のそれぞれが単独のものとして孤立することなく連関的に機能し、再生・細胞医療領域において優越的に事業展開できる源泉となるよう設計しております。
<用語解説>
| *6 | 第三者サブライセンス権 | 特許権者(ライセンサー)から特許の実施権を受けた実施権者(ライセンシー)が、ライセンスされた特許を、さらに第三者にライセンス(実施を許諾)することのできる権利 |
| *7 | 独占実施・許諾権 | 対象となる特許発明について、ライセンシー以外の第三者の実施・許諾を制限(ライセンシーのみに権利を付与)する内容でライセンサーがライセンシーに付与する権利 |
<当社事業にかかる重要な特許>
| 発明の名称 | 出願人 | 出願国 (注2) | 特許番号 | 内容・特徴 |
| ① 細胞の立体構造体の製造方法(注1) | 国立大学法人九州大学 | WO 日本 米国 欧州 | ― 特許第4517125号 US 8198086 B2 EP 2130910 B1 | 本発明は、任意の3次元空間に各種細胞を細胞塊として配置し、細胞のみから構成される所望の形状の立体構造体を作製する方法を提供する。また、細胞塊を任意の空間に配置するための支持体を提供する。上記支持体を使用して細胞塊を任意の空間に配置するための方法と立体的な細胞構築物を製造する方法を提供する。 |
| ② 組織プラグの 製造方法(注1) | 国立大学法人九州大学 | 日本 | 特許第4122280号 | 本発明は、細胞塊の培養方法、組織プラグの製造方法及び組織プラグを提供する。本発明の製造方法では、任意の形状のチャンバー内で細胞塊を培養し、その形状に対応する任意の形状の立体的組織プラグを作製する。 |
| ③ 細胞の立体構造体製造装置 | 当社、澁谷工業株式会社、国立大学法人佐賀大学(共同出願) | WO 日本 米国 欧州 | ― 特許第5896104号 US 9441194 B2 EP 2725091 B1 | 本発明は、立体構造体製造装置を提供する。本発明により、自動的に細胞の立体構造体を製造することができる。 |
| ④ 細胞構造体製造装置 | 当社 | WO 日本 米国 欧州 | ― 特許第6334837号 US 10961495 B2 EP 3514225 B1 | 本発明は、細胞の立体構造体を製造するために用いられる細胞構造体製造装置及び細胞構造体の製造方法に関する。本発明の製造装置及び製造方法では、穿刺した細胞塊を自由な形状で適切に突き刺すことができる。 |
(注1) 国立大学法人九州大学から当社へ独占ライセンスが付与されております。
(注2) 主要3か国(日米欧)とWO(国際事務局)を記載しております。欧州特許は、締約国毎ではなく欧州一括で表記しております。
2.当社のビジネスモデル
(1) ビジネスモデルの概要
当社では、従来技術・従来製品との比較優位性を背景に、世界初の革新的な「3D細胞製品」の実用化を主軸として戦略的・多面的に事業展開を進めております。当社は、3D細胞製品等の研究開発及び製造販売並びにこれらの付随業務の単一セグメントであり、①再生医療領域において、再生医療等製品の承認取得へ向けたパイプライン開発及び研究用細胞製品の受託、②創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発、③デバイス領域において、基盤技術を搭載した三次元細胞積層システム機器(バイオ3Dプリンタ及び消耗品)等の開発・販売及び細胞製品開発のための技術応用や新技術開発等を展開しております。
現在の主たる収益事業である3D細胞製品の開発委託や製造委託等の各種委託は、創薬や再生医療向けに複数の製品ラインナップを有しており、その顧客についてもアカデミアから事業会社まで幅広く、またバイオ3Dプリンタや関連消耗品のデバイス販売等も展開する等、当社では複数の収益源を有しています。
中長期的には、再生医療領域、創薬支援領域における共同開発パートナー企業からのライセンス収入、3D細胞製品の開発委託、製造委託等の各種受託及び基盤技術を搭載したデバイスの販売・レンタル等により、収益拡大を図ってまいります。
当社では、このような収益源の多様化及び収益性の向上を図ることによって、中長期成長のため必要となる製品実用化に向けて、研究開発をはじめとした先行投資によって継続的に発生する営業損失を段階的に縮減するとともに、アカデミアから事業会社まで幅広い顧客を継続的に獲得し、現在の複数の領域における事業収益を確実に成長させることで、製品上市後の収益安定化までの見通しを立てています。
(2) 当社の事業戦略
当社では、当社独自のビジネスモデルを発展拡大させ、デバイス普及により「ベース収益の確保」と「シーズ探索の拡大」を図り、創薬支援用途等の研究用組織による「早期のマネタイズ」の実現を経て、中長期的には「再生医療等製品の承認取得」を目指し、再生医療ベンチャーとしての事業価値最大化を図ってまいります。
当社独自の基盤技術を中核とした中長期的な事業展開としては、以下を想定しており、現状は、STEP2からSTEP3に移行している段階にあります。

図7.中長期事業戦略(イメージ)
① 再生医療領域
当社は、再生医療領域において、神経・骨軟骨・血管など様々な組織・臓器再生の再生医療パイプライン開発を進めております。詳細は「3.当社の開発パイプラインとアライアンス」以降をご参照ください。
② 創薬支援領域
当社は、創薬支援領域において、製薬企業等を相手方とした創薬支援用のツールとしての細胞製品の開発を進めております。
現在の一般的な新薬開発においては、主にシャーレ上で培養されたマウス由来細胞またはヒト初代培養肝細胞(*8)を用いて新薬候補化合物の毒性試験や代謝物の評価(*9)を行いますが、その細胞が有する薬物代謝機能(*10)は2~3日で低減してしまうことから、開発現場では、より長期間機能が持続する肝臓サンプルの開発が待ち望まれています。
当社では、新薬創出の開発現場における大きな課題の1つとして挙げられる肝毒性評価(*11)系の不足に対する取り組みとして、ヒト肝臓を用いた場合と同様の毒性評価結果が得られ、高い肝機能が長期間にわたり発現する新たなツールとして、ヒト肝細胞等の細胞のみからなるヒト肝臓構造体(*12)を開発しました。
2018年9月には、3D肝臓構造体による毒性評価モデルに関する研究開発について、国立研究開発法人新エネルギー・産業技術総合開発機構(NEDO)の「研究開発型ベンチャー支援事業/企業間連携スタートアップに対する事業化支援」の助成事業として採択されました。
また、同じく2018年9月に、積水メディカル株式会社と共同開発を実施している肝臓構造体の創薬支援領域としての実用化を加速していくことを目的として、積水化学工業株式会社と再生・細胞医療分野における研究開発及び事業化促進に関する業務提携契約を締結するに至っております。
今後も、これまで動物試験では検出できなかったヒト特異的な毒性の検出を早期に行い、臨床試験の前にヒト肝臓で起こりうる有害事象を事前に予測することが可能なヒト肝臓構造体の開発を進め、製薬企業や非臨床試験受託会社等の創薬研究のニーズに応えるとともに、将来的には、再生医療領域への応用も視野に実際の患者さまへの移植可能な肝臓構造体の研究開発を進めてまいります。
このように、当社独自の基盤技術は、再生医療の分野での実用化のみならず、創薬支援の分野においても、新薬開発における薬剤の評価や、疾患メカニズムの解明へのニーズに対する需要、及び臨床入り後の開発リスクの低減、コスト削減や研究効率向上に多面的に貢献することが期待されています。
<用語解説>
| *8 | ヒト初代培養肝細胞 | 初代培養とは、生体から採取した組織や細胞を播種して培養することを指し、ここでは研究開発用途で培養されたヒトの肝細胞を指す |
| *9 | 代謝物の評価 | 新薬候補化合物を取り入れることにより、体内で起こる合成や化学反応について身体に与える影響を判断すること |
| *10 | 薬物代謝機能 | 肝細胞として有している、薬物等の対外物質を分解、排出するための代謝反応を行う機能 |
| *11 | 肝毒性評価 | 肝臓に対して有害であるか、毒性があるかについて実験等により判断すること |
| *12 | ヒト肝臓構造体 | ヒトの肝機能を有する肝臓構造体 |
③ デバイス領域
当社は、デバイス領域において、細胞製品開発を進展させる基礎となる基盤技術を普及させるため、バイオ3Dプリンタ等のデバイスの開発・販売とともに、細胞製品開発に必要となる技術応用や新技術開発等を進めております。
当社は、上記の①再生医療領域及び②創薬支援領域に記載する細胞製品を作製するためのデバイスとして、バイオ3Dプリンタ「Regenova®(製品名:レジェノバ)」の販売を行っております。
これらのデバイスは、専用3Dソフトウエアでスフェロイドの三次元配置を指定して3Dデータを入力し、使用する剣山とスフェロイドをセットし稼働させることで、自動的に細胞の立体積層を行うことが可能となります。
当社は、これらのデバイスの販売を行うとともに、大学等の研究機関や企業の研究所等のデバイス利用者(ユーザー)向けに立体組織の作製に関するトレーニングメニューの提供をはじめ、ユーザーの研究を継続的に支援するためのサポート、消耗品、周辺機器の提供もあわせて行っております。
また、基盤技術の技術応用により開発された、再生医療等製品の開発における臨床用三次元細胞積層システムが、各再生医療プロジェクトの臨床試験において稼働しております。
さらに、再生・細胞医療分野の研究開発促進及び基盤技術普及を拡大することを目的として、新技術方式(*13)を搭載した新型バイオ3Dプリンタ「S-PIKE®(製品名:スパイク)」を販売しております。
なお、「S-PIKE®(製品名:スパイク)」の製品販売については、シスメックス株式会社との販売提携による共同販売を行い、基盤技術の普及を進めております。
当社では、これらデバイスによる基盤技術のグローバル展開を進めることで、様々な分野・領域での共同研究や共同開発が拡大し、新たなユーザーへの技術周知やシーズの開拓、細胞製品開発が大きく促進するものと見込んでおります。
<用語解説>
| *13 | 新技術方式 | 1本の微細な針にスフェロイドを配列・固定し、その複数のスフェロイドが固定された針を整列させることで自由度の高い立体的な組織を作製可能とする、当社が独自に発明・開発した新たな三次元細胞積層技術 |

図8.当社が製品化・販売するバイオ3Dプリンタ

図9.当社の事業系統図
3.当社の開発パイプラインとアライアンス
(1) 当社の主要パイプラインと開発進捗状況
当社の企業成長を中長期的に牽引する再生医療等製品の開発においては、従来の再生医療等製品とは異なり、人工の足場材料を使用せずに患者さまの細胞のみで作製された再生組織・臓器を、新たな再生医療等製品として製品化することを目指して、複数のパイプライン(末梢神経再生、骨軟骨再生、血管再生等の新たな再生医療等製品の開発品ラインナップ)の臨床開発を進めております。
また、この主要パイプラインに続く次世代のパイプライン(研究開発シーズ)の探索及び拡大を進めております。
本書提出日現在での開発計画に基づく、当社のパイプラインの開発ステータスは以下のとおりです。
なお、非臨床後期の段階にあるパイプラインに開発コードを付しております。

図10.当社のパイプラインの開発ステータス
末梢神経再生のための再生医療等製品(開発コード:CYF-PA1)については、現在医師主導治験を実施中で、2023年からの企業治験開始、2025年の承認申請、2026年の承認取得を予定しております。
骨・軟骨再生のための再生医療等製品(開発コード:CYF-CA1)については、現在医師主導治験の準備中で、2023年からの医師主導治験開始、2024年からの企業治験開始、2026年の承認申請、2026年内の承認取得を予定しております。
血管再生のための再生医療等製品(開発コード:CYF-BA1)については、現在臨床研究を実施中で、2023年以降の治験開始、2027年の承認申請、2027年内の承認取得を予定しております。
① 末梢神経(開発コード:CYF-PA1)
a.開発製品の概要
従来、末梢神経を損傷した患者さまには、ご自身の足から健常な神経を採取し、損傷部位に移植する自家神経移植またはシリコン製の人工神経等の移植法が採用されております。
しかしながら、自己の神経の採取には限界があり、また、採取した箇所に、しびれや痛み、麻痺が生じるなどの課題が、人工神経を移植した場合には神経の機能再生に乏しいという課題がありました。そのため、事故や腫瘍切除時に断裂損傷を受けた方々や自家神経移植が困難な方々にとっては、自己の健常な組織を犠牲にすることなく自身のQOL(Quality of Life)を大幅に向上させる新しい治療選択肢が大きく期待されています。
当社では、末梢神経損傷等から四肢の機能の回復を必要とされる患者さまへ、細胞製の三次元神経導管を移植することで、断裂した神経を再生し、感覚神経や運動神経が改善される新たな再生医療等製品の開発に取り組んでいます。
これまでの研究成果は「Scientific Report」「PLOS ONE」電子版「Cell Transplant」「Microsurgery」等の論文や米国科学雑誌「Newton」等に掲載され、自身の神経再生を促す新しい治療選択肢が大きく期待されています。

b.開発の進捗状況
当社が開発中の末梢神経再生のための三次元神経導管(以下、「当社製品」という。)については、独立行政法人医薬品医療機器総合機構(PMDA)へ治験届を提出し、京都大学医学部附属病院において医師主導治験(試験名称「末梢神経損傷を対象とした三次元神経導管移植による安全性と有効性を検討する医師主導治験」)(以下、「本治験」という。)を実施しております。
当社ではこれまでに京都大学医学部附属病院整形外科との共同研究において、神経損傷モデル動物を用いて三次元神経導管の有効性及び安全性を確認する非臨床試験を実施し、良好な結果を確認しました。
これらの結果をもとに、臨床試験のステージに開発を進め、末梢神経損傷患者を対象とした医師主導治験を実施しております。医師主導治験の概要は下表のとおりです。
<末梢神経損傷を対象とした三次元神経導管移植の治験概要>
| 治験名 | 末梢神経損傷を対象とした三次元神経導管移植による安全性と有効性を検討する医師主導治験 |
| 治験製品 | 三次元神経導管(自己皮膚組織由来線維芽細胞から製造する) |
| 対象疾患 | 直接の縫合ができない手関節遠位の末梢神経損傷 |
| 症例数 | 3例 |
| 治験デザイン | 単施設、単一群、非盲検、非対照 |
| 評価項目 | 安全性 |
| 主要評価項目 | 治験製品あるいは治験製品移植、及び治験製品の製造のために実施する皮膚組織の採取との関連性を否定できない有害事象及び不具合の発現割合 |
| 副次評価項目 | 有効性 1) 移植後48週のSW法による感覚機能検査結果 2) 移植後48週の二点識別法による感覚機能検査結果 |
本治験は、2020年11月開始後、本書提出日現在において、外傷性末梢神経損傷を有する患者さまへの移植を計画通り実施し、予定した3症例の全症例への移植が終了(2022年内に全症例が経過観察期間を終了する予定)しております。
本製品移植後、現在は治験実施計画書に基づき、定期的に経過観察及び評価(検査)が実施されております。実施されている検査としては、問診・触診等の一般診察の他、自他覚症状の確認感覚機能検査等が行われており、運動神経の回復や感覚の改善を術前と術後で比較し、確認がなされております。
その評価については、例えば、知覚及び触覚の回復度合いを、下記のようなイラスト図で示す評価方法(SW法:指針を用いた知覚テスト)を用いて評価が行われております。

図11.知覚機能検査の評価方法例
本書提出日現在において、移植が終了した全症例について本製品に起因する有害事象や不具合の発生は報告されておらず、順調に回復の兆しが示されていることについて、報告を受けております。
本治験の進捗状況については、治験実施医療機関である京都大学医学部附属病院整形外科ホームページ(https://www.seikei.kuhp.kyoto-u.ac.jp/)において最新の情報が掲載(2022年1月に更新)されております。また、2022年3月に開催された第21回日本再生医療学会においても報告がなされました。

図12.本治験症例における経過観察結果(日本再生医療学会総会発表資料参照)
医師主導治験後は、当社の開発方針に基づき、2023年から当社が主導する臨床試験である企業治験を実施し、2026年に本製品の製造販売承認を取得する計画です。
具体的には、2~3年の治験実施期間において、単一ではなく複数の治験実施医療機関において、数十例の症例数の患者に対して同じ試験内容の治験を共同で実施することにより、将来の医療現場に普及する状況が再現されることになり、当社製品の普及活動、関係医療機関等との連携及び製造販売流通体制の構築がより具体化していくことになります。企業治験の実施を通じて将来の製品製造販売承認へ向け必要となる体制を着実に構築・整備について十分に体制を整備・構築した上で、本製品の製造販売承認取得後のスムーズな販売開始へつなげることが可能となる計画です。
このような医師主導治験終了後に企業治験を実施するという本開発方針については、複数のパートナー企業との共同開発体制により、製造販売体制構築を進め、将来の着実な製品販売拡大につなげるという当社独自のアライアンス戦略とも合致するものであります。
なお、本製品の製造販売体制構築の状況等については、後述の「(2)当社のアライアンス戦略」及び「(3)当社のアライアンス状況」をご参照ください。
また、本医師主導治験の今後の進捗や結果の公表については、2022年内に現在経過観察期間中の3症例目を含めた全症例の経過観察期間終了後に、開発主体である医療機関側(京都大学医学部附属病院)において、本治験全症例に関する結果を取り纏めた統括報告書完成後の2023年中の発表を予定しております。
c.医師主導治験等の情報に関する開示等の方針
臨床試験に関する被験者の個別データについては、治験実施医療機関である京都大学医学部附属病院において、本製品移植後から経過観察をスタートし、移植4週目以降より、知覚検査等により本製品の移植による神経機能の改善が見られるか否かについて、定期的な検査が実施され、取得・管理されております。
なお、本治験における全実施症例が3例と極めて少数であるという特性上、被験者である患者さまの個人情報保護の観点から、移植部位の状況や損傷部位の回復の程度等の個別の症例に関する情報については、極めて慎重に取り扱われることになります。
また、本製品のような新規性の高い製品については、製品開発とは別に将来、本治験による成果を研究開発成果として治験実施責任医師による知的財産権化(特許等の申請等)する可能性があることから、当社の事業活動によってこれらの研究開発活動を阻害することがないよう、治験実施責任医師と連携して情報公開の対象・範囲・内容を設定しております。
以上のような事情に鑑み、当社では、臨床試験に関する情報の開示については、被験者である患者さまの個人情報保護の観点、治験実施医療機関における情報管理の観点、及び治験実施責任医師の研究開発活動における情報保護等の観点を複合的かつ最大限に考慮してまいる方針です。
本方針を踏まえ、定期的に開催されている学会等での発表を主たる情報開示とし、これに加え、試験進捗に応じて公開される抄録や論文等、実施医療機関から公開可能情報が出てきた段階で、かつ、上記3つの情報保護の観点に十分に配慮するかたちで適時適切に情報開示を行ってまいります。
また、当社では、上記原則に則りつつ、投資家の皆様への情報開示の重要性に鑑み、引き続き、実施医療機関との協議や被験者様の同意取得、治験実施医療機関の倫理委員会及び広報部における承認を得た場合には、適時適切に情報開示を行ってまいります。
当社では、今後も、当社が関与する臨床試験については医療機関と連携しながら、適時適切なタイミングで学会発表や論文公開等を通じて進捗報告や結果について公表してまいります。
② 骨・軟骨(開発コード:CYF-CA1)
a.開発製品の概要
関節の軟骨は血管が通っていないことから自己再生能力が極めて乏しく、一旦損傷すると再生することなく欠損が進行して重度化しやすい部位です。
従来の軟骨再生製品は、関節表面の薄い軟骨層の損傷のみを対象としており、軟骨層を支える軟骨下骨の層まで損傷が及ぶ場合には、人工関節への置換または経過観察による対処療法が選択されていました。
当社は、患者さま自身の間葉系幹細胞(*14)から当社の基盤技術によって細胞製の骨軟骨構造体(高密度スキャフォールドフリー脂肪由来幹細胞構造体:HDMAC(High Density Mesenchymal stem cell scaffold free Autologous Construct (HDMAC) )を作製し、骨軟骨の欠損部へ移植するという新たな治療法の開発を進めております。
この人工の足場材料を使用せずに作製した細胞製の骨軟骨構造体を欠損部へ移植することで、細胞自らが徐々に軟骨と骨に分化して、軟骨及び軟骨層を支える軟骨下骨それぞれの組織を再生することが確認されており、これまで効果的な治療法に乏しかった患者のQOL(Quality of Life)の向上に向けて大きな期待が寄せられています。これまでの研究成果は「Journal of Orthopaedic Surgery」等に掲載されています。

b.開発の進捗状況
これまでに九州大学病院において、変形性膝関節症をはじめとする患者さまへ細胞製骨軟骨を移植する製品開発を目指した臨床試験(プロジェクト名:「高密度スキャフォールドフリー脂肪由来幹細胞構造体(以下、「HDMAC」といいます。)を用いた骨軟骨組織再生の臨床研究」)を、国立研究開発法人日本医療研究開発機構(以下、「AMED」という。)による支援を受け実施し、全症例の移植を完了し、主要評価項目である安全性評価を達成し、ヒトでのPOC(Proof of concept)を取得致しました。現在、慶應義塾大学とともに早期の次相臨床試験開始に向け準備を継続しております。
当社の細胞製の骨軟骨構造体は、軟骨と軟骨下骨とを同時に再生させることが可能な新規の細胞製品であり、これまで効果的な治療法に乏しかった患者さまのQOL(Quality of Life)の向上に向けて期待が寄せられています。
今後は、この骨軟骨再生の開発をさらに進めるため、現在、慶應義塾大学と共に次相の臨床試験の開始に向け開発を進めており、これまで困難とされてきた関節硝子軟骨(*15)の再生と、さらには骨と軟骨の同時再生という治療方法で多くの患者さまに貢献することを目指してまいります。

<用語解説>
| *14 | 間葉系幹細胞 | 間葉(中胚葉性組織)系の細胞に分化する能力を持った細胞 |
| *15 | 関節硝子軟骨 | 関節面を覆う軟骨。一般的に言われる「軟骨」に該当 |
③ 血管(開発コード:CYF-BA1)
a.開発製品の概要
現在、腎不全等により血液透析を必要とされる患者さまの多くは、自己血管内シャント(*16)や人工血管を使用したバスキュラーアクセス(*17)法により治療されています。
しかしながら、従来の自己血管を用いた治療では、血管の採取に限界があり、また、人工血管では感染症や狭窄が生じてしまうことなどの課題がありました。
当社は、AMEDの支援を受け、「立体造形による機能的な生体組織製造技術の開発/細胞を用いた機能的な立体組織作成技術の研究開発」において、国立大学法人佐賀大学と共同で、細胞のみで作製した小口径細胞製血管(*18)の開発を進めてまいりました。

b.開発の進捗状況
本細胞製血管については、これまでにウサギやミニブタでの非臨床試験を実施し、非臨床POC(Proof of concept)を取得いたしました。本成果については、「Nature communications」に掲載されております。
これまでに、国立大学法人佐賀大学と共同で進めるAMED委託事業「バイオ3Dプリンタを用いて造形した小口径Scaffold free細胞人工血管の臨床研究」において臨床開発を進めております。
今後は、感染症に強く、高い弾力性を有する細胞製血管の開発をさらに進め、糖尿病をはじめとする血管障害を抱えている透析患者さまへ新たな治療の選択肢の提供をし、将来的には重症下肢虚血(*19)の血行再建や冠動脈バイパス術(*20)、脳血管・小児用血管等の領域への適用拡大を目指してまいります。
さらに将来的には、この細胞のみから作製された管状の細胞構造体による機能再建の技術が発展することにより、消化器、泌尿器等のような血管以外の管状構造を有する領域での適応拡大についても展望しております。
<用語解説>
| *16 | 自己血管内シャント | 動脈と静脈を直接つないで大量の血液が通るように施した血管。自己の血管を使用した場合には自己血管内シャントと呼ぶ。(人工血管を使用した場合は人工血管シャント) |
| *17 | バスキュラーアクセス | 血液透析を行うために手術で作製する専用の血管 |
| *18 | 小口径細胞製血管 | 6㎜以下の小口径の細胞のみからなる血管 |
| *19 | 重症下肢虚血 | 下肢(足)への血流障害である閉塞性動脈硬化症などが重症化した症状 |
| *20 | 冠動脈バイパス術 | 心臓に血液を供給する冠動脈が閉塞等の不具合が生じた際に、別の血管を接続する開胸心臓手術 |
(2) 当社のアライアンス戦略
当社では、従来技術・従来製品との比較優位性を背景に、創薬系ベンチャーとは異なる事業戦略に基づき、世界初の革新的な再生医療等製品の実用化を主軸として戦略的・多面的に事業展開を進めております。
当社が開発を進める再生医療等製品においては、医薬品と異なり、個体差のある材料である細胞の採取から培養、最終製品の出荷、輸送、患者への移植までの製品が届くステップが個別具体的なものとなるのが特徴です。
そのため、製品開発プロセスにおいても、単一の化合物についてのライセンスを保有するバイオベンチャー1社の企業が単独で、アウトソーシングやライセンスアウトに依存しながら開発を進めていく一般的な創薬系ベンチャーでの医薬品の開発(ライセンスアウトした企業自体に開発力が乏しい場合であっても医薬品の製品化自体は可能)と異なり、再生医療等製品の製品化にあたっては、企業や医療機関との連携や技術・設備・装置等の共同開発体制構築が必要不可欠といえます。
また、医薬品におけるアライアンスは、ライセンスの権利付与を前提とするのに対して、再生医療におけるアライアンスは、単なる権利移転のみならず、製品製造にかかる技術やノウハウ等の移管を要することから、当社では、将来の製造販売体制構築を視野に入れた共同開発体制を構築する独自のアライアンス戦略をとっています。
そして着実に開発を進めるため、製造設備等のインフラに関する技術やノウハウ・設備等を有する複数の医療機関・事業会社・行政機関等の外部パートナーとの共同開発体制(コンソーシアム)を形成することで、開発を加速させております。
このような当社独自のアライアンス戦略は、①1社単独による開発リスクを低減し、事業化パートナー企業と有機的に連携することにより、着実に製品化へ向けた確度の高い開発を進め、開発製品の上市の確度が大きく向上するとともに、②実用化に近いパイプラインを複数有し、かつ、製品ごとにターゲットマーケット及び販売戦略をすみ分けることで、事業リスクを低減し、事業計画実現の確度を高めるものです。
再生・細胞医療分野において世界初の製品上市により事業計画を実現することを目指す当社にあっては、その独自のアライアンス戦略に基づき、確実な最終製品化のためにライセンスパートナーへの技術移管を含めた製造販売体制を構築することが、結果として当社の製品のライセンスの価値を高め、ひいては当社の事業価値を増加していくものと考えております。
したがって、当社の再生医療等製品の上市の蓋然性については、実際の共同開発体制や開発パートナーの開発力・技術力が重要な判断指標となります。双方が保有する技術・ノウハウをハイブリッドさせることで、当社製品が安定的に供給できる体制になること、及び双方の技術を補完することで新たな市場を共に開拓していくことができるポテンシャルを有していることを合意の上、患者さまに新しい治療法の選択肢を安心安全にお届けする体制を構築していく方針です。
後述の「(3)当社のアライアンスの状況」に記載のとおり、当社では、すべての主要パイプラインについて、開発・製造・販売までを、専門性が高い開発力・技術力を有する複数の開発パートナーが有機的に連携し担うサプライチェーン構築が進んでおり、これにより、製品化についての蓋然性が高まっております。
具体的には、本書提出日現在、岩谷産業株式会社、太陽ホールディングス株式会社、日立グローバルライフソリューションズ株式会社、福岡地所株式会社、藤森工業株式会社及び株式会社メディパルホールディングス等の事業会社との業務提携等により、商業化を見据えた開発が大きく進んでおります。
今後は、このコンソーシアムを基盤として、製品の原材料である細胞の調達から製品製造、販売まで一気通貫で実施可能なサプライチェーンを構築し、将来の再生医療等製品の販売や顧客獲得拡大を図ってまいります。
(3) 当社のアライアンス状況
当社では現在、現在までに締結したパートナーシップにより、国内における製品の製造及び販売・搬送等のサプライチェーンの核となる部分についてはすでにサプライチェーンを確立しております。
具体的には、提携パートナー企業である太陽ホールディングス株式会社との間において業務提携契約を締結し、この当社独自の製品製造にかかる技術やノウハウ等の移管を含めたアライアンスに基づき、将来の当社製品の製造・販売体制構築へ向かって共同で事業化を進めてまいりました。
当社再生医療等製品の製造・販売体制の構築及び事業化に関する業務提携・製造施設の構築に関する業務提携をもとに、当社製品の臨床開発と並行して、太陽ホールディングス株式会社の子会社である太陽ファルマテック株式会社への製品製造技術移管を進め、2021年9月末に同社の高槻工場内に当社製品を製造することが可能な施設が竣工しました。
また、本施設には2020年7月に業務提携契約を締結した日立グローバルライフソリューションズ株式会社との間で共同開発した、コンパクトかつシームレスな製造設備を導入しており、共同開発成果を実用化する形で、製造施設の完成に至っております。本施設及び本体制においては、当社の開発する様々な種類の製品がその対象となる可能性があり、これにより当社においては、自社で製造方法が確立され、量産化に向けた見通しがある状況にあります。
さらに、2021年12月には、再生医療等製品の安定的な流通販売体制を構築することを目的として、株式会社メディパルホールディングスとの間で「再生医療等製品の実用化へ向けた開発投資契約」を締結し、同社が開発を進める再生医療等製品を医療機関へ提供するサプライチェーンの構築及びより一層の製造販売体制強化が実現しております。
これに加えて、当社では、すでに当社が形成している整形外科領域を中心とする医療機関等との連携を軸として、医薬品とは異なる再生医療等製品独自の販売ルートを確保している状況にあり、さらに今後の提携パートナー企業との連携による販売ルート拡大も見込まれます。
今後は、現状の国内での体制構築に加え、グローバルでの事業展開を視野に入れ、海外進出のためのさらなるサプライチェーンの拡大や海外の現地企業、研究機関及び医療機関等との連携に基づく海外におけるサプライチェーンの構築等を強化していく方針です。
