訂正有価証券報告書-第7期(平成26年1月1日-平成26年12月31日)
事業内容
当社グループは、単一セグメントであるため、セグメントの情報は記載しておりません。
(1)事業の概要
当社グループ(当社及び当社の子会社)は、当社(ラクオリア創薬株式会社)及び子会社(株式会社AskAt)により構成されております。
当社グループは、先端科学技術を活用し、医療分野においてニーズの高い疾患領域に対する新たな医薬品を生み出すことを目指す研究開発型の創薬企業であり、独自に創出した新薬の開発化合物(*)の知的財産権を製薬会社等に対して導出(使用許諾契約によりライセンスアウト)することにより収益を獲得することを事業展開の基本としております。
① 当社グループの事業の背景
製薬産業は、中国を始めとする新興市場の需要拡大や多様化する医療ニーズへの対応等により、今後も更なる成長が見込まれております。その一方で、既存医薬品の特許切れによるジェネリック医薬品の参入、医療保険の適用基準の厳格化の影響等により、今後、医薬品販売高の成長率は鈍化するといった指摘もあります。
特に、平成20年以降、大手製薬会社の大型医薬品の特許切れが続くことから、特許切れに伴う収益減少を補完するため、これらの製薬会社にとっては、新たな医薬品の開発が重要な課題となっております。しかし、近年臨床試験の厳格化等により、開発期間が長期化し、製薬会社の研究開発費が増加する傾向にある一方で、新薬の承認取得数は減少傾向にあるため、新薬開発の効率化が製薬会社の課題となっております。
このような状況の中、製薬会社は、医薬品として成功する可能性の高い高品質な開発化合物を、社内の研究のみならず外部にも求める傾向にあり、当社グループは研究開発型の創薬企業としてその期待に応えるべく、前身である日本ファイザー社旧中央研究所にて蓄積した創薬研究に係る経験及びノウハウ等を活用し、事業を展開しております。
② 医薬品研究開発の一般的進行(*)及び当社グループの事業領域
一般的に新薬の開発は、探索研究、前臨床試験、臨床試験、厚生労働省(あるいは米国食品医薬品局(FDA:Food and Drug Administration)等の各国の医薬品許認可審査機関)への製造販売承認申請、医薬品としての承認取得、薬価基準収載(*)を経て行われます。その後、初めて新薬として販売が開始され、病院・医師・患者へ提供することが可能となります。
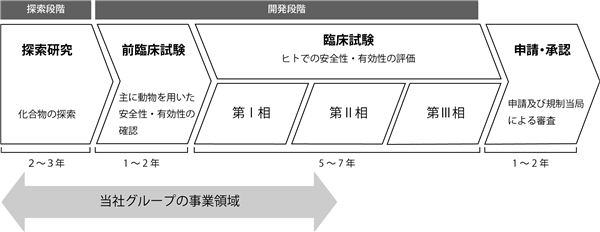
(注)医薬品の研究開発における標準的な各段階の所要年数は、あくまでも標準的な想定期間を表示したものであり、各プロジェクトがこの想定期間どおりに進捗するとは限りません。各プロジェクトが経過した、あるいは現在進行中の各段階の幅についても、実際の所要期間あるいは想定所要期間を示すものではありません。
当社グループは、医薬品の研究開発段階のうち、探索研究段階、前臨床試験段階及び臨床試験段階(うち一部)を主たる事業分野としております。臨床試験段階においては多額の研究開発費が必要となるため、当社グループにおける研究開発に係る費用及びリスク負担を低減する目的から、安全性及び有効性が概ね評価可能となる段階(必要に応じて前期第Ⅱ相臨床試験を実施)までを当社グループにて行い、その後製薬会社等へ開発化合物を導出することを基本としております。
③ 低分子化合物医薬品の開発
当社グループは、低分子化合物医薬に係る研究開発を行っております。近年、医薬品業界においては、抗体医薬やワクチン等のいわゆるバイオ医薬の研究開発が盛んに行われておりますが、低分子化合物は依然として医薬品開発の大きな柱であります。当社グループにおいては、低分子化合物医薬において高い専門性を有していることから、当面は低分子化合物医薬を中心とした研究開発を推進していく方針であります。
④ 研究開発活動
(A)研究開発の概要
当社グループの研究開発部門が行っている研究開発の概要とその流れは、以下のとおりであります。当社グループでは、創薬標的分子(*)の探索から初期臨床試験(主として第Ⅰ相臨床試験まで、必要に応じて第Ⅱ相臨床試験を一部実施)まで、博士・修士号を有した研究者を中心にこの業務を推進しております。
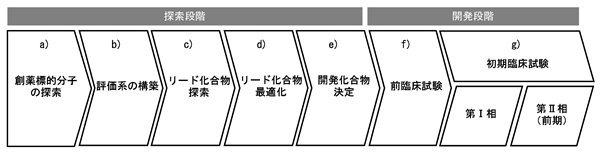
(B)当社グループの研究開発体制
当社グループは、前身である日本ファイザー社旧中央研究所の創薬研究に係る主要な機能を引き継いでおります。当社グループは、研究領域において豊富な知識、経験及びノウハウを有する従業員が在籍するほか、日本ファイザー社より研究機器等の研究設備を譲り受けるなど、国内外の研究機関に引けを取らない創薬研究開発環境が構築されているものと考えております。
a)プロジェクトを中心とした研究開発体制
当社グループの研究開発体制は、プロジェクトを中心とした階層の少ない組織により運営されており、迅速な意思決定及び業務の遂行を可能にしております。実際の業務の多くは、プロジェクト単位で協議され決定されます。重要な方針に関わる判断が必要な場合は、プロジェクトから経営戦略委員会へ提案が行われ、その決定は速やかにプロジェクト活動に反映されます。
b)研究・開発・営業活動の一体化
当社グループにおいては、探索研究から開発そして導出に至るまで、プロジェクトチームが主体性を持ち、相互に関連して、部門横断的に業務を実施しております。これにより、実施する試験に無駄がなく、かつ必要な情報を随時取得し、これらの結果を適切に導出先企業に提供することを可能としております。
(C)研究開発ポートフォリオ(*)による展開
当社グループの研究開発は、創薬の初期段階を担うものであり、少数の限られたプロジェクトに経営資源を集中するのではなく、新たなプロジェクトを継続して創出することにより、研究開発ポートフォリオを拡充し、製薬会社等へ開発化合物を導出していくことに重点を置いたものであります。
医薬品開発は、研究開発のいずれの段階においても、安全性、有効性及び薬物動態(*)並びにその他の開発上の問題から中止される可能性があります。当社グループにおいては、探索段階から海外市場において上市済みのものまで、各段階のプロジェクトを保有しており、さらに、自社の探索研究から新たな開発化合物を継続して創出する能力を備えていることから、複数のプロジェクトからなる研究開発ポートフォリオを拡充するとともに、開発リスクを低減し、より安定した事業の遂行を図りたいと考えております。
⑤ 営業(導出)活動
当社グループの営業活動は、前臨床試験及び臨床試験を通じて、ヒトにおける安全性及び有効性が評価可能となった段階にて、開発化合物を製薬会社へ導出することを基本としております。しかしながら、近年、各製薬会社等においては医薬品として成功する可能性の高い高品質な開発化合物を、研究開発の段階を問わず、外部の創薬ベンチャー企業や研究機関等に求めるケースが増加していることから、当社グループは、初期探索段階から開発段階までの各段階において保有する研究開発ポートフォリオのすべてを導出対象とし、機動的かつ柔軟な営業活動を展開しております。
また、当社グループの研究開発ポートフォリオは、その研究開発戦略の特性から、全世界を対象とする開発、販売及び製造に関する権利の導出を最優先の目標としておりますが、一方では、それに捉われることなく、各プロジェクトの特性と顧客である製薬会社等のニーズに応じて、日本・東アジア・欧州等の地域ごとの導出、あるいは剤形(経口剤、注射剤、局所用途剤)ごとの導出、さらには動物用医薬品用途での導出等、収益の最大化を図るべく様々な形態で導出を図る方針であります。
⑥ 当社グループの収益
当社グループの収益は、探索研究、前臨床試験及び初期臨床試験の成果として創出した開発化合物を製薬会社等に導出することにより獲得するものであり、その概要は以下のとおりであります。
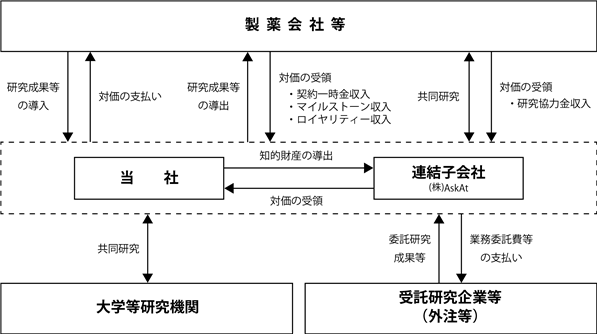
⑦ 事業系統図
当社グループの事業の系統図は、以下のとおりであります。
(2)当社グループの研究開発対象領域及び研究開発ポートフォリオ
① 当社グループの研究開発対象領域
当社グループは、前身である日本ファイザー社旧中央研究所時代から引き続き、主として疼痛疾患領域及び消化管疾患領域を研究開発の中核として位置付けており、当該領域における経験豊富な人材を維持し、ノウハウを蓄積しているものと考えております。当該2つの事業領域に関して、医薬品としての全世界の市場規模は拡大傾向にあります。当社グループは、今後も両疾患領域は市場成長が見込まれるものと想定しており、これら領域を重点領域として研究開発を推進していく方針であります。
② 当社グループのポートフォリオ及び研究開発の状況
臨床試験段階においては、多額の研究開発費が必要となるため、当社グループにおける研究開発に係る費用及びリスク負担を軽減することを目的として、当社グループ保有の開発化合物について「選択と集中」を図っております。
具体的には、自社リソースを活用するプログラムを「Coreプログラム」、外部リソースを活用するプログラムを「戦略的オプションプログラム」と定義し、前者については内部リソースを集中することにより早期収益の獲得を目指し、また、後者については、導出によって外部リソースを積極的に活用することで開発ステージをアップさせ、プロジェクトの価値を向上させて将来的な収益の獲得を目指してまいります。
当連結会計年度末現在の主な「Coreプログラム」及び「戦略的オプションプログラム」の状況は、以下のとおりであります。
(A)Coreプログラム
当連結会計年度末現在、「Coreプログラム」は以下のとおりであります。当社は、これらのプロジェクトに関して一部導出済みの契約を除き、全世界を対象とする開発、販売及び製造に関する権利を有しております。
(注)1.化合物コードは、RQ-で始まるコードで表記されており、当社グループで研究・開発・評価に使用するすべての化合物に対して付与しております。
2.導出済みプロジェクトの詳細については、「③当社グループの導出済みプログラム等 (A)導出済みプログラム」をご参照ください。
3.本プロジェクトは、平成26年4月1日にCJ CheilJedang CorporationよりCJ HealthCare Corporationへ継承されています。
(B)戦略的オプションプログラム
当連結会計年度末現在、「戦略的オプションプログラム」は、以下のとおりであります。
なお、これらのプロジェクトに関しては、当社の連結子会社である株式会社AskAtに承継又は譲渡しております。契約内容の詳細については、後述の「第2 事業の状況 5経営上の重要な契約等」をご参照ください。
(注)1.化合物コードは、RQ-で始まるコードで表記されており、当社グループで研究・開発・評価に使用するすべての化合物に対して付与しております。
2.AAT-で始まる化合物コードは、当社の連結子会社株式会社AskAtでのコード表記であります。
3.米国ファイザー社において、他の適応症に係る第Ⅰ相臨床試験を終了しております。
4.米国ファイザー社において、前期第Ⅱ相臨床試験を終了しております。
5.導出済みプロジェクトの詳細については、「③当社グループの導出済みプログラム等 (A)導出済みプログラム」をご参照ください。
③ 当社グループの導出済みプログラム等
当社グループの契約済みのポートフォリオは、「導出済みプログラム」、「権利再許諾済みプログラム」、「権利譲渡済みプログラム」及び「共同研究プログラム」に区分され、当連結会計年度末現在の状況は、以下のとおりであります。なお、契約内容の詳細については、後述の「第2 事業の状況 5 経営上の重要な契約等」をご参照ください。
(A)導出済みプログラム
当連結会計年度末現在、製薬会社等に導出済みのプロジェクトは、以下のとおりであります。
(注)本プロジェクトは、平成26年4月1日にCJ CheilJedang CorporationよりCJ HealthCare Corporationへ継承されています。
(B)権利再許諾済みプログラム
当連結会計年度末現在、製薬会社等に再許諾済みのプロジェクトは、以下のとおりであります。
(C)権利譲渡済みプログラム
当連結会計年度末現在、製薬会社等に権利譲渡済みのプロジェクトは、以下のとおりであります。
(注)Durata Therapeutics, Inc.(米国)は、平成26年11月17日にジェネリック薬メーカーのActavis(米国)に買収されております。
(D)共同研究プログラム
当連結会計年度末現在、製薬会社等と共同研究中のプロジェクトは、以下のとおりであります。
(1)事業の概要
当社グループ(当社及び当社の子会社)は、当社(ラクオリア創薬株式会社)及び子会社(株式会社AskAt)により構成されております。
当社グループは、先端科学技術を活用し、医療分野においてニーズの高い疾患領域に対する新たな医薬品を生み出すことを目指す研究開発型の創薬企業であり、独自に創出した新薬の開発化合物(*)の知的財産権を製薬会社等に対して導出(使用許諾契約によりライセンスアウト)することにより収益を獲得することを事業展開の基本としております。
① 当社グループの事業の背景
製薬産業は、中国を始めとする新興市場の需要拡大や多様化する医療ニーズへの対応等により、今後も更なる成長が見込まれております。その一方で、既存医薬品の特許切れによるジェネリック医薬品の参入、医療保険の適用基準の厳格化の影響等により、今後、医薬品販売高の成長率は鈍化するといった指摘もあります。
特に、平成20年以降、大手製薬会社の大型医薬品の特許切れが続くことから、特許切れに伴う収益減少を補完するため、これらの製薬会社にとっては、新たな医薬品の開発が重要な課題となっております。しかし、近年臨床試験の厳格化等により、開発期間が長期化し、製薬会社の研究開発費が増加する傾向にある一方で、新薬の承認取得数は減少傾向にあるため、新薬開発の効率化が製薬会社の課題となっております。
このような状況の中、製薬会社は、医薬品として成功する可能性の高い高品質な開発化合物を、社内の研究のみならず外部にも求める傾向にあり、当社グループは研究開発型の創薬企業としてその期待に応えるべく、前身である日本ファイザー社旧中央研究所にて蓄積した創薬研究に係る経験及びノウハウ等を活用し、事業を展開しております。
② 医薬品研究開発の一般的進行(*)及び当社グループの事業領域
一般的に新薬の開発は、探索研究、前臨床試験、臨床試験、厚生労働省(あるいは米国食品医薬品局(FDA:Food and Drug Administration)等の各国の医薬品許認可審査機関)への製造販売承認申請、医薬品としての承認取得、薬価基準収載(*)を経て行われます。その後、初めて新薬として販売が開始され、病院・医師・患者へ提供することが可能となります。

(注)医薬品の研究開発における標準的な各段階の所要年数は、あくまでも標準的な想定期間を表示したものであり、各プロジェクトがこの想定期間どおりに進捗するとは限りません。各プロジェクトが経過した、あるいは現在進行中の各段階の幅についても、実際の所要期間あるいは想定所要期間を示すものではありません。
当社グループは、医薬品の研究開発段階のうち、探索研究段階、前臨床試験段階及び臨床試験段階(うち一部)を主たる事業分野としております。臨床試験段階においては多額の研究開発費が必要となるため、当社グループにおける研究開発に係る費用及びリスク負担を低減する目的から、安全性及び有効性が概ね評価可能となる段階(必要に応じて前期第Ⅱ相臨床試験を実施)までを当社グループにて行い、その後製薬会社等へ開発化合物を導出することを基本としております。
③ 低分子化合物医薬品の開発
当社グループは、低分子化合物医薬に係る研究開発を行っております。近年、医薬品業界においては、抗体医薬やワクチン等のいわゆるバイオ医薬の研究開発が盛んに行われておりますが、低分子化合物は依然として医薬品開発の大きな柱であります。当社グループにおいては、低分子化合物医薬において高い専門性を有していることから、当面は低分子化合物医薬を中心とした研究開発を推進していく方針であります。
④ 研究開発活動
(A)研究開発の概要
当社グループの研究開発部門が行っている研究開発の概要とその流れは、以下のとおりであります。当社グループでは、創薬標的分子(*)の探索から初期臨床試験(主として第Ⅰ相臨床試験まで、必要に応じて第Ⅱ相臨床試験を一部実施)まで、博士・修士号を有した研究者を中心にこの業務を推進しております。

(B)当社グループの研究開発体制
当社グループは、前身である日本ファイザー社旧中央研究所の創薬研究に係る主要な機能を引き継いでおります。当社グループは、研究領域において豊富な知識、経験及びノウハウを有する従業員が在籍するほか、日本ファイザー社より研究機器等の研究設備を譲り受けるなど、国内外の研究機関に引けを取らない創薬研究開発環境が構築されているものと考えております。
a)プロジェクトを中心とした研究開発体制
当社グループの研究開発体制は、プロジェクトを中心とした階層の少ない組織により運営されており、迅速な意思決定及び業務の遂行を可能にしております。実際の業務の多くは、プロジェクト単位で協議され決定されます。重要な方針に関わる判断が必要な場合は、プロジェクトから経営戦略委員会へ提案が行われ、その決定は速やかにプロジェクト活動に反映されます。
b)研究・開発・営業活動の一体化
当社グループにおいては、探索研究から開発そして導出に至るまで、プロジェクトチームが主体性を持ち、相互に関連して、部門横断的に業務を実施しております。これにより、実施する試験に無駄がなく、かつ必要な情報を随時取得し、これらの結果を適切に導出先企業に提供することを可能としております。
(C)研究開発ポートフォリオ(*)による展開
当社グループの研究開発は、創薬の初期段階を担うものであり、少数の限られたプロジェクトに経営資源を集中するのではなく、新たなプロジェクトを継続して創出することにより、研究開発ポートフォリオを拡充し、製薬会社等へ開発化合物を導出していくことに重点を置いたものであります。
医薬品開発は、研究開発のいずれの段階においても、安全性、有効性及び薬物動態(*)並びにその他の開発上の問題から中止される可能性があります。当社グループにおいては、探索段階から海外市場において上市済みのものまで、各段階のプロジェクトを保有しており、さらに、自社の探索研究から新たな開発化合物を継続して創出する能力を備えていることから、複数のプロジェクトからなる研究開発ポートフォリオを拡充するとともに、開発リスクを低減し、より安定した事業の遂行を図りたいと考えております。
⑤ 営業(導出)活動
当社グループの営業活動は、前臨床試験及び臨床試験を通じて、ヒトにおける安全性及び有効性が評価可能となった段階にて、開発化合物を製薬会社へ導出することを基本としております。しかしながら、近年、各製薬会社等においては医薬品として成功する可能性の高い高品質な開発化合物を、研究開発の段階を問わず、外部の創薬ベンチャー企業や研究機関等に求めるケースが増加していることから、当社グループは、初期探索段階から開発段階までの各段階において保有する研究開発ポートフォリオのすべてを導出対象とし、機動的かつ柔軟な営業活動を展開しております。
また、当社グループの研究開発ポートフォリオは、その研究開発戦略の特性から、全世界を対象とする開発、販売及び製造に関する権利の導出を最優先の目標としておりますが、一方では、それに捉われることなく、各プロジェクトの特性と顧客である製薬会社等のニーズに応じて、日本・東アジア・欧州等の地域ごとの導出、あるいは剤形(経口剤、注射剤、局所用途剤)ごとの導出、さらには動物用医薬品用途での導出等、収益の最大化を図るべく様々な形態で導出を図る方針であります。
⑥ 当社グループの収益
当社グループの収益は、探索研究、前臨床試験及び初期臨床試験の成果として創出した開発化合物を製薬会社等に導出することにより獲得するものであり、その概要は以下のとおりであります。
| 収 益 | 内 容 |
| 契約一時金収入 | 契約締結時に、当社グループが提供するそれまでの研究成果の対価等として受け取る収入 |
| マイルストーン収入 | 契約相手先の研究開発の進捗(契約書に規定された研究開発段階の達成)に応じて受け取る収入 |
| ロイヤリティー収入 | 医薬品の上市後に販売額の一定料率を受け取る収入 |
| 研究協力金収入 | 共同研究で設定された条件に従って、共同研究の開始に伴い当社グループのそれまでの研究成果を提供する対価等として受け取る収入及び共同研究の期間中に提供する役務等の対価等として受け取る収入 |
⑦ 事業系統図
当社グループの事業の系統図は、以下のとおりであります。

(2)当社グループの研究開発対象領域及び研究開発ポートフォリオ
① 当社グループの研究開発対象領域
当社グループは、前身である日本ファイザー社旧中央研究所時代から引き続き、主として疼痛疾患領域及び消化管疾患領域を研究開発の中核として位置付けており、当該領域における経験豊富な人材を維持し、ノウハウを蓄積しているものと考えております。当該2つの事業領域に関して、医薬品としての全世界の市場規模は拡大傾向にあります。当社グループは、今後も両疾患領域は市場成長が見込まれるものと想定しており、これら領域を重点領域として研究開発を推進していく方針であります。
② 当社グループのポートフォリオ及び研究開発の状況
臨床試験段階においては、多額の研究開発費が必要となるため、当社グループにおける研究開発に係る費用及びリスク負担を軽減することを目的として、当社グループ保有の開発化合物について「選択と集中」を図っております。
具体的には、自社リソースを活用するプログラムを「Coreプログラム」、外部リソースを活用するプログラムを「戦略的オプションプログラム」と定義し、前者については内部リソースを集中することにより早期収益の獲得を目指し、また、後者については、導出によって外部リソースを積極的に活用することで開発ステージをアップさせ、プロジェクトの価値を向上させて将来的な収益の獲得を目指してまいります。
当連結会計年度末現在の主な「Coreプログラム」及び「戦略的オプションプログラム」の状況は、以下のとおりであります。
(A)Coreプログラム
当連結会計年度末現在、「Coreプログラム」は以下のとおりであります。当社は、これらのプロジェクトに関して一部導出済みの契約を除き、全世界を対象とする開発、販売及び製造に関する権利を有しております。
| プロジェクト | 化合物 コード | 主適応症 | 開発段階 | 臨床試験の実施地域 | 導出状況 |
| 5-HT4部分作動薬 | RQ-00000010 | 胃不全麻痺 機能性胃腸症 慢性便秘 | 第Ⅰ相臨床試験 | 英国 | ― |
| 前臨床試験 | 韓国 | CJ CheilJedang Corporation (韓国) (注)3 | |||
| アシッドポンプ 拮抗薬 | RQ-00000004 | 胃食道逆流症 | 第Ⅱ相臨床試験 | 韓国 | CJ CheilJedang Corporation (韓国) (注)3 |
| 第Ⅰ相臨床試験 | 米国 | ― | |||
| 第Ⅰ相臨床試験 | 日本 | ― | |||
| RQ-00000774 | 胃食道逆流症 | 探索段階 | ― | ― | |
| モチリン受容体 作動薬 | RQ-00201894 | 胃不全麻痺 機能性胃腸症 術後イレウス | 前臨床試験 | ― | ― |
| 5-HT2B拮抗薬 | RQ-00310941 | 下痢型過敏 性腸症候群 (*) | 前臨床試験 | ― | ― |
| グレリン受容体 作動薬 | ― | 癌に伴う食欲不振 | 探索段階 | ― | ― |
| TRPM8遮断薬 | ― | 神経因性疼痛 | 探索段階 | ― | ― |
(注)1.化合物コードは、RQ-で始まるコードで表記されており、当社グループで研究・開発・評価に使用するすべての化合物に対して付与しております。
2.導出済みプロジェクトの詳細については、「③当社グループの導出済みプログラム等 (A)導出済みプログラム」をご参照ください。
3.本プロジェクトは、平成26年4月1日にCJ CheilJedang CorporationよりCJ HealthCare Corporationへ継承されています。
(B)戦略的オプションプログラム
当連結会計年度末現在、「戦略的オプションプログラム」は、以下のとおりであります。
なお、これらのプロジェクトに関しては、当社の連結子会社である株式会社AskAtに承継又は譲渡しております。契約内容の詳細については、後述の「第2 事業の状況 5経営上の重要な契約等」をご参照ください。
| プロジェクト | 化合物 コード | 主適応症 | 研究開発段階 | 臨床試験の実施地域 | 導出先 |
| EP4拮抗薬 | RQ-00000007 (AAT-007) | 慢性炎症性疼痛 | 第Ⅱ相臨床試験 | 米国 | 丸石製薬株式会社 Aratana Therapeutics, Inc.(米国) |
| 急性痛、炎症、自己免疫疾患、アレルギー、癌 | 前臨床試験 (注)3 | ― | ― | ||
| RQ-00000008 (AAT-008) | 慢性炎症性疼痛、 急性痛、炎症、自己免疫疾患、アレルギー、癌 | 前臨床試験 | ― | ― | |
| 5-HT4部分作動薬 | RQ-00000009 (AAT-009) | アルツハイマー病 | 前臨床試験 (注)3 | ― | ― |
| シクロオキシゲナーゼ-2 (COX-2)阻害薬 | RQ-00317076 (AAR-076) | 急性痛 | 第Ⅱ相臨床試験 (注)4 | 米国 | ― |
(注)1.化合物コードは、RQ-で始まるコードで表記されており、当社グループで研究・開発・評価に使用するすべての化合物に対して付与しております。
2.AAT-で始まる化合物コードは、当社の連結子会社株式会社AskAtでのコード表記であります。
3.米国ファイザー社において、他の適応症に係る第Ⅰ相臨床試験を終了しております。
4.米国ファイザー社において、前期第Ⅱ相臨床試験を終了しております。
5.導出済みプロジェクトの詳細については、「③当社グループの導出済みプログラム等 (A)導出済みプログラム」をご参照ください。
③ 当社グループの導出済みプログラム等
当社グループの契約済みのポートフォリオは、「導出済みプログラム」、「権利再許諾済みプログラム」、「権利譲渡済みプログラム」及び「共同研究プログラム」に区分され、当連結会計年度末現在の状況は、以下のとおりであります。なお、契約内容の詳細については、後述の「第2 事業の状況 5 経営上の重要な契約等」をご参照ください。
(A)導出済みプログラム
当連結会計年度末現在、製薬会社等に導出済みのプロジェクトは、以下のとおりであります。
| プロジェクト | 化合物 コード | 想定 適応症 | 剤形 | 対象 | 導出先における研究開発段階 | 権利地域 | 導出先 | |
| ヒト | 動物 | |||||||
| EP4拮抗薬 | RQ-00000007 | 術後疼痛 癌性疼痛 | 注射剤 | ○ | ○ | 前臨床試験 | 日本及び東アジア(中国・韓国・台湾) | 丸石製薬株式会社 |
| 急性疼痛 慢性疼痛 | ― | ○ | 臨床試験 (米国) | 全世界 (但し、注射剤については日本、中国、韓国、台湾を除く) | Aratana Therapeutics, Inc.(米国) | |||
| グレリン受容体作動薬 | RQ-00000005 | 体重減少 食欲不振 | ― | ○ | 臨床試験 (米国) | 全世界 | Aratana Therapeutics, Inc.(米国) | |
| プロジェクト | 化合物 コード | 想定 適応症 | 剤形 | 対象 | 導出先における研究開発段階 | 権利地域 | 導出先 | |
| ヒト | 動物 | |||||||
| 5-HT4部分作動薬 | RQ-00000010 | 消化管 疾患 | ― | ○ | 前臨床試験 (韓国) | 韓国、中国(香港を含む)、台湾、インド及び東南アジア | CJ CheilJedang Corporation (韓国) (注) | |
| アシッドポンプ 拮抗薬 | RQ-00000004 | 消化管 疾患 | ― | ○ | 第Ⅲ相臨床試験準備中 (韓国) | 韓国、中国(香港を含む)、台湾及び東南アジア | CJ CheilJedang Corporation (韓国) (注) | |
| RQ-00000774 | 消化管 疾患 | ― | ○ | 探索段階 | 韓国、中国(香港を含む)、 台湾及び東南アジア | CJ CheilJedang Corporation (韓国) (注) | ||
(注)本プロジェクトは、平成26年4月1日にCJ CheilJedang CorporationよりCJ HealthCare Corporationへ継承されています。
(B)権利再許諾済みプログラム
当連結会計年度末現在、製薬会社等に再許諾済みのプロジェクトは、以下のとおりであります。
| プロジェクト | 化合物 コード | 想定適応症 | 剤形 | 研究開発段階 | 権利地域 | 導出先 |
| ジプラシドン | RQ-00000003 | 統合失調症 双極性障害 | 経口剤 | 第Ⅲ相臨床試験 準備中 | 日本 | Meiji Seika ファルマ株式会社 |
(C)権利譲渡済みプログラム
当連結会計年度末現在、製薬会社等に権利譲渡済みのプロジェクトは、以下のとおりであります。
| プロジェクト | 化合物 コード | 想定適応症 | 剤形 | 研究開発段階 | 権利地域 | 導出先 |
| ダルババンシン | RQ-00000002 | MRSA(*) 感染症 | ― | 製品販売中 (米国) 前臨床試験 (日本) | 日本 | Durata Therapeutics, Inc.(米国) (注) |
(注)Durata Therapeutics, Inc.(米国)は、平成26年11月17日にジェネリック薬メーカーのActavis(米国)に買収されております。
(D)共同研究プログラム
当連結会計年度末現在、製薬会社等と共同研究中のプロジェクトは、以下のとおりであります。
| プロジェクト | 化合物コード | 共同研究先 | 研究開発段階 |
| 特定のイオンチャネルを標的とした新規消化器疾患治療薬 | ― | 味の素製薬株式会社 | 探索研究を実施中 |
| タンパク質間相互作用を標的とした新規鎮痛薬 | ― | インタープロテイン株式会社 | 探索研究を実施中 |
| 特定のキナーゼを標的とした新規治療薬 | ― | カルナバイオサイエンス株式会社 | 探索研究を実施中 |
| 特定のイオンチャネルを標的とした新規治療薬 | ― | 旭化成ファーマ株式会社 | 探索研究を実施中 |