有価証券報告書-第107期(平成30年4月1日-平成31年3月31日)
研究開発活動
当期における研究開発費は、144,844百万円(前期比3.8%増)、売上収益比率22.5%(前期より0.7ポイント減)となりました。
なお、当社グループは、研究開発費をグローバルに管理しているため、セグメントに配分していません。
[開発品の状況]
○ 抗がん剤「レンビマ」(一般名:レンバチニブ、欧州における腎細胞がんに係る製品名:「Kisplyx」)
・甲状腺がんに係る適応において、日本、米国、欧州、アジア等の55カ国以上で承認を取得しています。中国において、甲状腺がんを対象としたフェーズⅢ試験が進行中です。
・腎細胞がん(セカンドライン)を対象とした、エベロリムスとの併用療法に係る適応において、米国、欧州等の45カ国以上で承認を取得しています。
・肝細胞がん(ファーストライン)に係る適応において、45カ国以上で承認を取得しています。2018年3月に日本で、同年8月に米国、欧州、韓国で、同年9月に中国で承認を取得しました。
・腎細胞がん(ファーストライン)を対象とした、エベロリムスあるいは米メルク社の抗PD-1 抗体ペムブロリズマブとの2つの併用療法に関するフェーズⅢ試験が日本、米国、欧州において進行中です。
・ペムブロリズマブとの併用療法による進行性または転移性腎細胞がんの適応に対して、米国においてブレイクスルーセラピーの指定を受けています。
・子宮内膜がん(セカンドライン)を対象としたペムブロリズマブとの併用療法に関するフェーズⅢ試験を日本、米国、欧州等において開始し、進行中です。2018年7月、マイクロサテライト不安定性が低頻度または陰性、あるいはDNA ミスマッチ修復機能を有し、少なくとも1回の全身治療歴がある進行性または転移性の子宮内膜がんに係る適応に対して、米国においてブレイクスルーセラピーの指定を受けました。
・ペムブロリズマブとの併用療法について、肝細胞がん(ファーストライン)を対象としたフェーズⅢ試験を日本、米国、欧州、中国で、メラノーマ(セカンドライン)を対象としたフェーズⅡ試験を米国、欧州で、それぞれ開始し、進行中です。また、子宮内膜がん(ファーストライン)、メラノーマ(ファーストライン)、非扁平上皮非小細胞肺がん(ファーストライン)、PD-L1 陽性の非小細胞肺がん(ファーストライン)、ならびに膀胱がん(ファーストライン)を対象としたフェーズⅢ試験を米国、欧州等で開始しました。さらに、複数のがん腫(セカンドライン)を対象としたバスケット試験(フェーズⅡ試験)を米国、欧州で開始しました。
・胆道がんを対象としたフェーズⅡ試験が日本において進行中です。
・RET 転座を有する非小細胞肺がんを対象としたフェーズⅡ試験が日本、米国、欧州、アジアにおいて進行中です。
○ 抗がん剤「ハラヴェン」(一般名:エリブリン)
・乳がんに係る適応において、日本、米国、欧州、アジア等の65カ国以上で承認を取得しています。中国における乳がんに係る適応について、承認申請中です。
・脂肪肉腫(日本では悪性軟部腫瘍)に係る適応において、日本、米国、欧州、アジア等の60カ国以上で承認を取得しています。
・トリプルネガティブ乳がんを対象としたペムブロリズマブとの併用療法に関するフェーズⅠ/Ⅱ試験が米国において進行中です。
・HER2 ネガティブ乳がんを対象とした、Halozyme Therapeutics Inc.(米国)が開発中のPEG 化遺伝子組換えヒト型ヒアルロン酸分解酵素PEGPH20 との併用療法に関するフェーズⅠ/Ⅱ試験が米国において進行中です。
○ 抗てんかん剤「フィコンパ」(一般名:ペランパネル、英名「Fycompa」)
・12歳以上の部分てんかん併用療法に係る適応において、日本、米国、欧州、アジア等の55カ国以上で承認を取得しています。
・12歳以上の全般てんかんの強直間代発作に対する併用療法に係る適応において、日本、米国、欧州、アジア等の50カ国以上で承認を取得しています。
・米国において、部分てんかんの単剤療法での使用に関する承認を取得しています。
・2018年9月、米国において、4歳以上の小児てんかん患者様の部分発作に対する単剤および併用療法に関する承認を取得しました。
・2018年10月、中国において、部分てんかんの併用療法に係る適応の新薬承認申請が受理され、2019年1月に優先審査の指定を受けました。
・2019年1月、日本において、部分てんかんの単剤療法および小児適応(4歳以上)、並びに細粒剤に係る追加申請を行いました。
・2019年2月、欧州において、小児てんかんに係る適応拡大の追加申請を行いました。
・レノックス・ガストー症候群を対象としたフェーズⅢ試験が日本、米国、欧州において進行中です。
○ 2019年2月、日本において、「ヒュミラ」について、化膿性汗腺炎に関する効能・効果の追加承認を取得しました。
○ 2018年10月、デュアルオレキシン受容体拮抗剤「E2006」(一般名:レンボレキサント)について、不眠障害を対象とした2つ目のフェーズⅢ試験において主要評価項目を達成し、2018年12月に米国において、2019年3月に日本において、不眠障害に係る適応でそれぞれ新薬承認申請を行いました。
○ 2018年6月、βサイト切断酵素阻害剤「E2609」(一般名:elenbecestat)のアルツハイマー病による軽度認知障害および軽度から中等度アルツハイマー病を対象としたフェーズⅡ試験の18カ月時点トップライン解析において、安全性と良好な忍容性が確認されるとともに、アミロイドPET による脳内アミロイド蓄積量の統計学的に有意な減少が示されました。また、臨床症状に対する有効性については、臨床症状評価スケールにおいて、臨床的に重要な変化と考えうる数値的な悪化抑制が観察されました。また、2019年3月、進行中のアルツハイマー病による軽度認知障害および軽度アルツハイマー病(総称して早期アルツハイマー病)を対象としたフェーズⅢ試験(MISSION AD)について、8回目の独立安全性データモニタリング委員会において、認知機能の悪化の有無を含めた安全性データがレビューされ、本試験の継続が推奨されました。
○ 2018年7月、抗アミロイドβプロトフィブリル抗体「BAN2401」の早期アルツハイマー病を対象としたフェーズⅡ試験の18カ月時点の最終解析において、臨床症状および脳内アミロイド蓄積量の両エンドポイントを統計学的な有意差をもって達成し、疾患修飾効果を確認しました。2019年3月、「BAN2401」の早期アルツハイマー病を対象としたフェーズⅢ試験を開始しました。
○ 2018年7月、肥満症治療剤「Belviq」(一般名:lorcaserin)の安全性評価を主要目的とする市販後臨床試験として実施した心血管疾患アウトカム試験において、主要心血管イベント(MACE: Major Adverse Cardiovascular Events、心血管死、心筋梗塞、脳卒中)の発生頻度がプラセボ投与群と比較して増加しないことが確認され、主要安全性評価目的を達成しました。MACE に「入院を要する不安定狭心症もしくは心不全、または冠血行再建術」を加えた主要有効性評価項目であるMACE+の発生頻度については、プラセボ投与群と比較して統計学的非劣性が確認されました。
○ 2018年9月、中心循環系血管内塞栓促進用補綴材「ディーシー ビーズ」(高度管理医療機器)について、使用目的又は効果の一部削除が承認され、使用目的又は効果が「多血性腫瘍(子宮筋腫を除く)を有する患者に対する動脈塞栓療法」となりました。
○ 2019年4月、日本でフェーズⅠ試験が進行中である線維芽細胞増殖因子受容体(FGFR1、FGFR2、FGFR3)選択的チロシンキナーゼ阻害剤「E7090」について、FGFR2 融合遺伝子を有する切除不能な胆道がんに対する治療を対象に、厚生労働省の「先駆け審査指定制度」の対象に指定されました。
○ 神経疾患治療剤「E2730」について、てんかんを対象としたフェーズⅡ試験を米国において開始し、進行中です。
○ 神経疾患治療剤「E2082」について、てんかんを対象としたフェーズⅡ試験を米国において開始し、進行中です。
○ 抗フラクタルカイン抗体「E6011」について、クローン病を対象としたフェーズⅡ試験を日本と欧州において開始し、進行中です。日本で実施していた関節リウマチを対象としたフェーズⅡ試験については、試験が完了し、得られた結果を踏まえて、次の開発ステップを検討中です。また、日本でフェーズⅡ試験段階にありました原発性胆汁性胆管炎を対象とした開発を中止しました。
○ 2019年3月、バイオジェン社と共同開発している抗アミロイドβ抗体アデュカヌマブ(一般名)のアルツハイマー病による軽度認知障害および軽度アルツハイマー病を対象としたグローバルフェーズⅢ試験(ENGAGE 試験、EMERGE 試験)について、独立データモニタリングコミッティにより行われた無益性解析の結果、主要評価項目が達成される可能性が低いと判断されたことに基づき、中止を決定しました。
○ 分岐鎖アミノ酸製剤「リーバクト」について、中国でフェーズⅢ試験段階にありました低アルブミン血症を対象とした開発を中止しました。


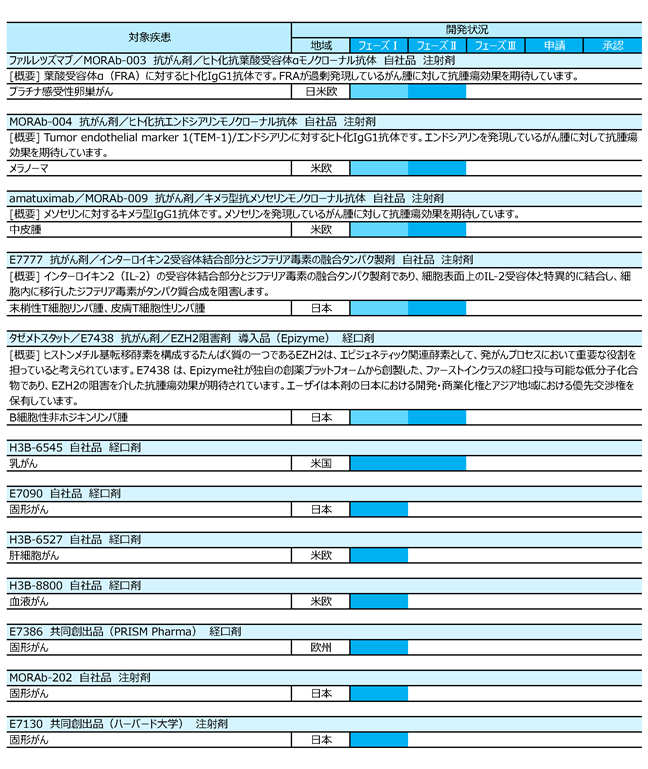

なお、当社グループは、研究開発費をグローバルに管理しているため、セグメントに配分していません。
[開発品の状況]
○ 抗がん剤「レンビマ」(一般名:レンバチニブ、欧州における腎細胞がんに係る製品名:「Kisplyx」)
・甲状腺がんに係る適応において、日本、米国、欧州、アジア等の55カ国以上で承認を取得しています。中国において、甲状腺がんを対象としたフェーズⅢ試験が進行中です。
・腎細胞がん(セカンドライン)を対象とした、エベロリムスとの併用療法に係る適応において、米国、欧州等の45カ国以上で承認を取得しています。
・肝細胞がん(ファーストライン)に係る適応において、45カ国以上で承認を取得しています。2018年3月に日本で、同年8月に米国、欧州、韓国で、同年9月に中国で承認を取得しました。
・腎細胞がん(ファーストライン)を対象とした、エベロリムスあるいは米メルク社の抗PD-1 抗体ペムブロリズマブとの2つの併用療法に関するフェーズⅢ試験が日本、米国、欧州において進行中です。
・ペムブロリズマブとの併用療法による進行性または転移性腎細胞がんの適応に対して、米国においてブレイクスルーセラピーの指定を受けています。
・子宮内膜がん(セカンドライン)を対象としたペムブロリズマブとの併用療法に関するフェーズⅢ試験を日本、米国、欧州等において開始し、進行中です。2018年7月、マイクロサテライト不安定性が低頻度または陰性、あるいはDNA ミスマッチ修復機能を有し、少なくとも1回の全身治療歴がある進行性または転移性の子宮内膜がんに係る適応に対して、米国においてブレイクスルーセラピーの指定を受けました。
・ペムブロリズマブとの併用療法について、肝細胞がん(ファーストライン)を対象としたフェーズⅢ試験を日本、米国、欧州、中国で、メラノーマ(セカンドライン)を対象としたフェーズⅡ試験を米国、欧州で、それぞれ開始し、進行中です。また、子宮内膜がん(ファーストライン)、メラノーマ(ファーストライン)、非扁平上皮非小細胞肺がん(ファーストライン)、PD-L1 陽性の非小細胞肺がん(ファーストライン)、ならびに膀胱がん(ファーストライン)を対象としたフェーズⅢ試験を米国、欧州等で開始しました。さらに、複数のがん腫(セカンドライン)を対象としたバスケット試験(フェーズⅡ試験)を米国、欧州で開始しました。
・胆道がんを対象としたフェーズⅡ試験が日本において進行中です。
・RET 転座を有する非小細胞肺がんを対象としたフェーズⅡ試験が日本、米国、欧州、アジアにおいて進行中です。
○ 抗がん剤「ハラヴェン」(一般名:エリブリン)
・乳がんに係る適応において、日本、米国、欧州、アジア等の65カ国以上で承認を取得しています。中国における乳がんに係る適応について、承認申請中です。
・脂肪肉腫(日本では悪性軟部腫瘍)に係る適応において、日本、米国、欧州、アジア等の60カ国以上で承認を取得しています。
・トリプルネガティブ乳がんを対象としたペムブロリズマブとの併用療法に関するフェーズⅠ/Ⅱ試験が米国において進行中です。
・HER2 ネガティブ乳がんを対象とした、Halozyme Therapeutics Inc.(米国)が開発中のPEG 化遺伝子組換えヒト型ヒアルロン酸分解酵素PEGPH20 との併用療法に関するフェーズⅠ/Ⅱ試験が米国において進行中です。
○ 抗てんかん剤「フィコンパ」(一般名:ペランパネル、英名「Fycompa」)
・12歳以上の部分てんかん併用療法に係る適応において、日本、米国、欧州、アジア等の55カ国以上で承認を取得しています。
・12歳以上の全般てんかんの強直間代発作に対する併用療法に係る適応において、日本、米国、欧州、アジア等の50カ国以上で承認を取得しています。
・米国において、部分てんかんの単剤療法での使用に関する承認を取得しています。
・2018年9月、米国において、4歳以上の小児てんかん患者様の部分発作に対する単剤および併用療法に関する承認を取得しました。
・2018年10月、中国において、部分てんかんの併用療法に係る適応の新薬承認申請が受理され、2019年1月に優先審査の指定を受けました。
・2019年1月、日本において、部分てんかんの単剤療法および小児適応(4歳以上)、並びに細粒剤に係る追加申請を行いました。
・2019年2月、欧州において、小児てんかんに係る適応拡大の追加申請を行いました。
・レノックス・ガストー症候群を対象としたフェーズⅢ試験が日本、米国、欧州において進行中です。
○ 2019年2月、日本において、「ヒュミラ」について、化膿性汗腺炎に関する効能・効果の追加承認を取得しました。
○ 2018年10月、デュアルオレキシン受容体拮抗剤「E2006」(一般名:レンボレキサント)について、不眠障害を対象とした2つ目のフェーズⅢ試験において主要評価項目を達成し、2018年12月に米国において、2019年3月に日本において、不眠障害に係る適応でそれぞれ新薬承認申請を行いました。
○ 2018年6月、βサイト切断酵素阻害剤「E2609」(一般名:elenbecestat)のアルツハイマー病による軽度認知障害および軽度から中等度アルツハイマー病を対象としたフェーズⅡ試験の18カ月時点トップライン解析において、安全性と良好な忍容性が確認されるとともに、アミロイドPET による脳内アミロイド蓄積量の統計学的に有意な減少が示されました。また、臨床症状に対する有効性については、臨床症状評価スケールにおいて、臨床的に重要な変化と考えうる数値的な悪化抑制が観察されました。また、2019年3月、進行中のアルツハイマー病による軽度認知障害および軽度アルツハイマー病(総称して早期アルツハイマー病)を対象としたフェーズⅢ試験(MISSION AD)について、8回目の独立安全性データモニタリング委員会において、認知機能の悪化の有無を含めた安全性データがレビューされ、本試験の継続が推奨されました。
○ 2018年7月、抗アミロイドβプロトフィブリル抗体「BAN2401」の早期アルツハイマー病を対象としたフェーズⅡ試験の18カ月時点の最終解析において、臨床症状および脳内アミロイド蓄積量の両エンドポイントを統計学的な有意差をもって達成し、疾患修飾効果を確認しました。2019年3月、「BAN2401」の早期アルツハイマー病を対象としたフェーズⅢ試験を開始しました。
○ 2018年7月、肥満症治療剤「Belviq」(一般名:lorcaserin)の安全性評価を主要目的とする市販後臨床試験として実施した心血管疾患アウトカム試験において、主要心血管イベント(MACE: Major Adverse Cardiovascular Events、心血管死、心筋梗塞、脳卒中)の発生頻度がプラセボ投与群と比較して増加しないことが確認され、主要安全性評価目的を達成しました。MACE に「入院を要する不安定狭心症もしくは心不全、または冠血行再建術」を加えた主要有効性評価項目であるMACE+の発生頻度については、プラセボ投与群と比較して統計学的非劣性が確認されました。
○ 2018年9月、中心循環系血管内塞栓促進用補綴材「ディーシー ビーズ」(高度管理医療機器)について、使用目的又は効果の一部削除が承認され、使用目的又は効果が「多血性腫瘍(子宮筋腫を除く)を有する患者に対する動脈塞栓療法」となりました。
○ 2019年4月、日本でフェーズⅠ試験が進行中である線維芽細胞増殖因子受容体(FGFR1、FGFR2、FGFR3)選択的チロシンキナーゼ阻害剤「E7090」について、FGFR2 融合遺伝子を有する切除不能な胆道がんに対する治療を対象に、厚生労働省の「先駆け審査指定制度」の対象に指定されました。
○ 神経疾患治療剤「E2730」について、てんかんを対象としたフェーズⅡ試験を米国において開始し、進行中です。
○ 神経疾患治療剤「E2082」について、てんかんを対象としたフェーズⅡ試験を米国において開始し、進行中です。
○ 抗フラクタルカイン抗体「E6011」について、クローン病を対象としたフェーズⅡ試験を日本と欧州において開始し、進行中です。日本で実施していた関節リウマチを対象としたフェーズⅡ試験については、試験が完了し、得られた結果を踏まえて、次の開発ステップを検討中です。また、日本でフェーズⅡ試験段階にありました原発性胆汁性胆管炎を対象とした開発を中止しました。
○ 2019年3月、バイオジェン社と共同開発している抗アミロイドβ抗体アデュカヌマブ(一般名)のアルツハイマー病による軽度認知障害および軽度アルツハイマー病を対象としたグローバルフェーズⅢ試験(ENGAGE 試験、EMERGE 試験)について、独立データモニタリングコミッティにより行われた無益性解析の結果、主要評価項目が達成される可能性が低いと判断されたことに基づき、中止を決定しました。
○ 分岐鎖アミノ酸製剤「リーバクト」について、中国でフェーズⅢ試験段階にありました低アルブミン血症を対象とした開発を中止しました。



