四半期報告書-第99期第3四半期(令和3年7月1日-令和3年9月30日)
(1) 財政状態に関する説明
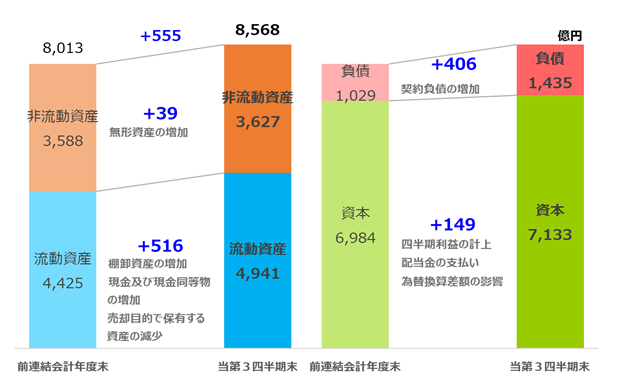
(単位:億円)
| 前連結会計年度末 | 2021年12月期 第3四半期 | 増減 | |
| 資産 | 8,013 | 8,568 | 555 |
| 非流動資産 流動資産 | 3,588 4,425 | 3,627 4,941 | 39 516 |
| 負債 | 1,029 | 1,435 | 406 |
| 資本 | 6,984 | 7,133 | 149 |
| 親会社所有者帰属持分比率(%) | 87.2% | 83.2% | △3.9% |
◎ 資産は、前連結会計年度末に比べ555億円増加し、8,568億円となりました。
・非流動資産は、販売権の減損や投資有価証券の売却による減少等がありましたが、開発品の導入による無形資産の増加等により、前連結会計年度末に比べ39億円増加し、3,627億円となりました。
・流動資産は、売却目的で保有する資産(日立化成ダイアグノスティックス・システムズ(株)株式)の減少がありましたが、当該資産の売却による収入やKHK4083の共同開発・販売に関する契約に基づくアムジェン社からの契約一時金による収入等による現金及び現金同等物の増加に加え、棚卸資産の増加等もあり、前連結会計年度末に比べ516億円増加し、4,941億円となりました。
◎ 負債は、アムジェン社との契約締結に伴う契約負債の増加等により、前連結会計年度末に比べ406億円増加し、1,435億円となりました。
◎ 資本は、配当金の支払いによる減少等がありましたが、親会社の所有者に帰属する四半期利益の計上や為替影響による在外営業活動体の換算差額による増加等により、前連結会計年度末に比べ149億円増加し、7,133億円となりました。なお、当第3四半期連結会計期間末の親会社所有者帰属持分比率は、前連結会計年度末に比べ3.9ポイント減少し、83.2%となりました。
(2) 経営成績に関する説明
① 業績の概況
当社グループは、グローバルに事業を展開しておりますことから、国際会計基準(以下「IFRS」という。)を適用しておりますが、事業活動による経常的な収益性を示す段階利益として「コア営業利益」を採用しております。当該「コア営業利益」は、「売上総利益」から「販売費及び一般管理費」及び「研究開発費」を控除し、「持分法による投資損益」を加えて算出しております。
(単位:億円)
| 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 | 前年同期比 % | |
| 売上収益 | 2,340 | 2,540 | 200 | 8.5% |
| コア営業利益 | 507 | 468 | △39 | △7.6% |
| 税引前四半期利益 | 442 | 419 | △23 | △5.2% |
| 親会社の所有者に帰属する四半期利益 | 375 | 329 | △46 | △12.2% |
<期中平均為替レート>
| 通貨 | 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 |
| 米ドル(USD/円) | 108円 | 108円 | -円 |
| 英ポンド(GBP/円) | 137円 | 149円 | 12円 |
| 人民元(CNY/円) | 15.4円 | 16.6円 | 1.2円 |
当第3四半期連結累計期間(2021年1月1日から9月30日までの9か月間)の売上収益は2,540億円(前年同期比8.5%増)、コア営業利益は468億円(同7.6%減)となりました。親会社の所有者に帰属する四半期利益は329億円(同12.2%減)となりました。
◎ 売上収益は、日本は減収となったものの、北米及びEMEAにおいてグローバル戦略品が順調に伸長し、アジアにおいても中国を中心に前年同期を上回った結果、増収となりました。なお、売上収益に係る為替の増収影響は46億円となりました。
◎ コア営業利益は、海外売上収益の増収により売上総利益が増益となったものの、販売費及び一般管理費や研究開発費が増加し、減益となりました。なお、コア営業利益に係る為替の増益影響は11億円となりました。
◎ 親会社の所有者に帰属する四半期利益は、その他の費用が減少したものの、コア営業利益の減益に加え、法人所得税費用が増加したため、減益となりました。
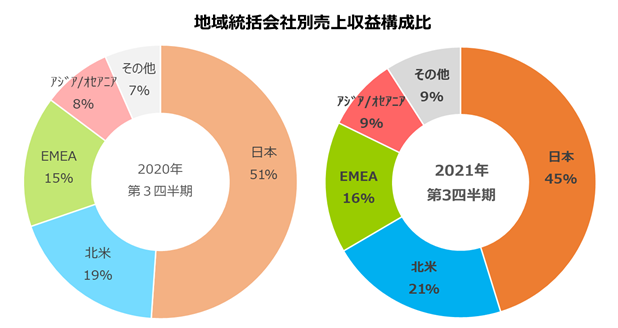
② 地域統括会社別の売上収益
(単位:億円)
| 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 | 前年同期比 % | |
| 日本 | 1,195 | 1,149 | △47 | △3.9% |
| 北米 | 437 | 542 | 105 | 24.1% |
| EMEA | 363 | 398 | 36 | 9.8% |
| アジア/オセアニア | 191 | 221 | 29 | 15.4% |
| その他 | 154 | 230 | 76 | 49.2% |
| 売上収益合計 | 2,340 | 2,540 | 200 | 8.5% |
(注)1.One Kyowa Kirin 体制(日本・北米・EMEA・アジア/オセアニアの4つの「地域」とグローバル・スペシャリティファーマとして必要な「機能」を軸とするグローバルマネジメント体制)における地域統括会社(連結)の製商品の売上収益を基礎として区分しております。
2.EMEAは、ヨーロッパ、中東及びアフリカ等であります。
3.その他は、技術収入及び受託製造収入等であります。
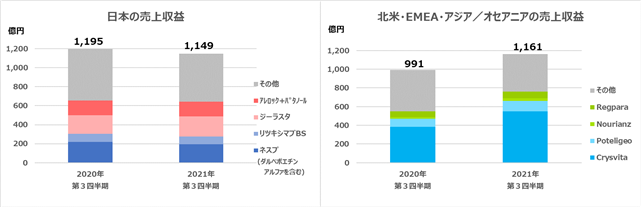
<日本の概況>(単位:億円)
| 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 | 前年同期比 % | |
| ダルベポエチン アルファ注シリンジ 「KKF」 | 186 | 167 | △20 | △10.5% |
| ジーラスタ | 196 | 212 | 16 | 8.2% |
| ロミプレート | 58 | 49 | △9 | △15.8% |
| パタノール | 87 | 92 | 5 | 5.5% |
| クリースビータ | 24 | 51 | 27 | 113.2% |
| (参考)アサコール・ミニリンメルト ・デスモプレシン | 19 | - | △19 | △100.0% |
◎ 日本の売上収益は、FGF23関連疾患治療剤クリースビータ等の新製品群が伸長したものの、2020年4月及び2021年4月に実施された薬価基準引下げの影響があったことに加え、一部製品の共同販売等終了の影響により、前年同期に比べ減少しました。
・腎性貧血治療剤ダルベポエチン アルファ注シリンジ「KKF」は、競合品の浸透の影響を受け、売上収益が減少しました。
・発熱性好中球減少症発症抑制剤ジーラスタは、堅調に売上収益を伸ばしました。
・慢性特発性血小板減少性紫斑病治療剤ロミプレートは、特約店への出荷調整(2020年6月から2021年3月まで)により、売上収益が減少しました。
・抗アレルギー点眼剤パタノールは、花粉飛散量の増加により、売上収益が増加しました。
・FGF23関連疾患治療剤クリースビータは、2019年の発売以来、順調に市場浸透しております。
・潰瘍性大腸炎治療剤アサコールは2020年3月31日をもって、中枢性尿崩症用剤ミニリンメルト及びデスモプレシンは2020年4月27日をもって、それぞれ当社による販売を終了したことにより、売上収益が減少しました。
<北米・EMEA・アジア/オセアニアの概況>(単位:億円)
| 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 | 前年同期比 % | |
| Crysvita | 385 | 551 | 165 | 42.9% |
| Poteligeo | 84 | 110 | 25 | 29.9% |
| Nourianz | 17 | 31 | 14 | 80.1% |
| Regpara | 61 | 67 | 6 | 10.6% |
| Abstral | 76 | 63 | △14 | △18.1% |
◎ 北米の売上収益は、グローバル戦略品が順調に伸長し、前年同期を上回りました。
・X染色体連鎖性低リン血症治療剤Crysvita(日本製品名:クリースビータ)は、2018年の発売以来、順調に売上収益を伸ばしております。2020年6月には腫瘍性骨軟化症(TIO)の適応追加の承認を取得しました。
・抗悪性腫瘍剤Poteligeo(日本製品名:ポテリジオ)は、堅調に売上収益を伸ばしました。
・パーキンソン病治療剤Nourianz(日本製品名:ノウリアスト)は、2019年10月に発売し、売上収益を伸ばしております。
◎ EMEAの売上収益は、グローバル戦略品が順調に伸長し、前年同期を上回りました。
・X染色体連鎖性低リン血症治療剤Crysvita(日本製品名:クリースビータ)が、2018年の発売以来、上市国を拡大しながら順調に売上収益を伸ばしております。2020年9月には青少年及び成人への適用拡大の販売承認を取得しました。
・2020年6月にドイツにおいて抗悪性腫瘍剤Poteligeo(日本製品名:ポテリジオ)の販売を開始し、上市国を拡大しながら順調に市場浸透しております。
・癌疼痛治療剤Abstral(日本製品名:アブストラル)は、後発医薬品の浸透の影響や出荷調整等により、売上収益が前年同期を下回りました。
◎ アジア/オセアニアの売上収益は、中国を中心に前年同期を上回りました。
・二次性副甲状腺機能亢進症治療剤Regpara(日本製品名:レグパラ)は、中国において売上収益が増加しました。
<その他の売上収益>◎ その他の売上収益は、前年同期を上回りました。
・アストラゼネカ社からのベンラリズマブに関する売上ロイヤルティの増加に加え、ヒト型抗OX40モノクローナル抗体KHK4083の自己免疫疾患であるアトピー性皮膚炎等を対象とした共同開発・販売に関する契約をアムジェン社と締結したこと、抗LIGHTヒト型モノクローナル抗体に関する全ての適応症及び全世界での開発、製造及び販売の権利をアーヴィ ジェノミック メディシン社に許諾する契約を締結したことに伴い技術収入が増加しました。
③ コア営業利益
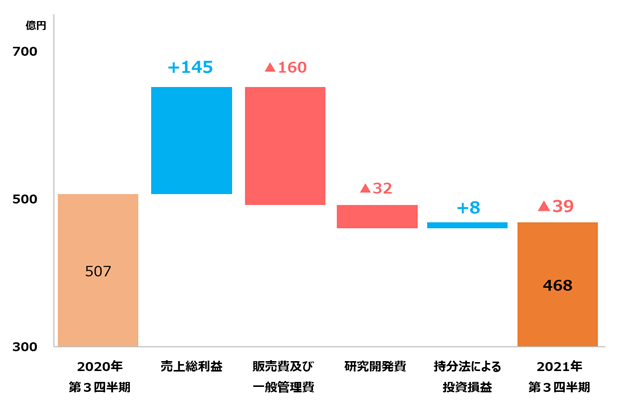
◎ コア営業利益は、グローバル戦略品を中心とした海外の売上収益の増加に伴う売上総利益の増加があったものの、グローバル戦略品の価値最大化と競争力あるグローバルビジネス基盤の早期確立に向けた販売費及び一般管理費の増加や研究開発費の増加等により、前年同期に比べ減益となりました。
(3) キャッシュ・フローに関する説明
(単位:億円)
| 2020年12月期 第3四半期 | 2021年12月期 第3四半期 | 増減 | 前年同期比 % | |
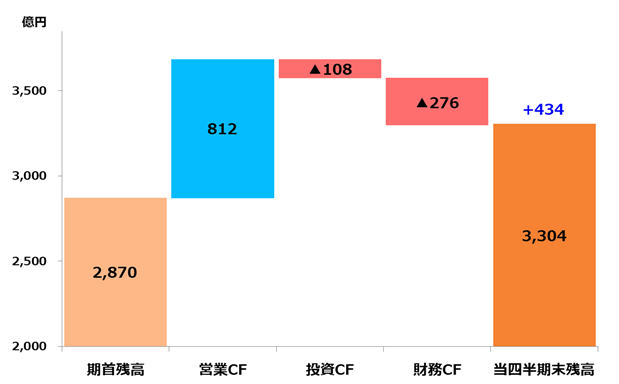
| 営業活動によるキャッシュ・フロー | 319 | 812 | 493 | 154.8% |
| 投資活動によるキャッシュ・フロー | 2,587 | △108 | △2,695 | - |
| 財務活動によるキャッシュ・フロー | △259 | △276 | △16 | 6.3% |
| 現金及び現金同等物の期首残高 | 208 | 2,870 | 2,663 | - |
| 現金及び現金同等物の四半期末残高 | 2,850 | 3,304 | 454 | 15.9% |
◎ 当第3四半期連結累計期間における現金及び現金同等物の期末残高は、前連結会計年度末の2,870億円に比べ434億円増加し、3,304億円となりました。
当第3四半期連結累計期間における各キャッシュ・フローの状況とそれらの要因は、次のとおりであります。
◎ 営業活動によるキャッシュ・フローは、812億円の収入(前年同期は319億円の収入)となりました。主な収入要因は、税引前四半期利益419億円、減価償却費及び償却費141億円に加えて、KHK4083の共同開発・販売に関する契約に基づくアムジェン社からの400百万ドルの契約一時金の入金を含む契約負債の増減額412億円等であります。一方、主な支出要因は、法人所得税の支払額139億円等であります。
◎ 投資活動によるキャッシュ・フローは、108億円の支出(前年同期は2,587億円の収入)となりました。主な支出要因は、無形資産の取得による支出125億円、有形固定資産の取得による支出49億円等であります。一方、収入要因は、持分法で会計処理されている投資の売却による収入51億円、投資有価証券の売却による収入18億円であります。
◎ 財務活動によるキャッシュ・フローは、276億円の支出(前年同期は259億円の支出)となりました。主な支出要因は、配当金の支払額242億円等であります。
(4) 優先的に対処すべき事業上及び財務上の課題
当第3四半期連結累計期間において、優先的に対処すべき事業上及び財務上の課題について重要な変更はありません。
(5)研究開発活動
当社グループは、研究開発活動へ資源を継続的かつ積極的に投入しております。多様なモダリティを駆使して画期的新薬を生み出すプラットフォームを築く技術軸と、これまで培った疾患サイエンスを活かしつつ有効な治療法のない疾患に"only-one value drug"を提供し続ける疾患軸の両方を進化させ、競合優位性の高いパイプラインを構築し、Life-changingな価値をもつ新薬をグローバルに展開することを目指しております。
当第3四半期連結累計期間における当社グループの研究開発費の総額は402億円であり、主な後期開発品の各疾患領域における進捗は、次のとおりであります。(◆は当第3四半期連結会計期間の進捗)
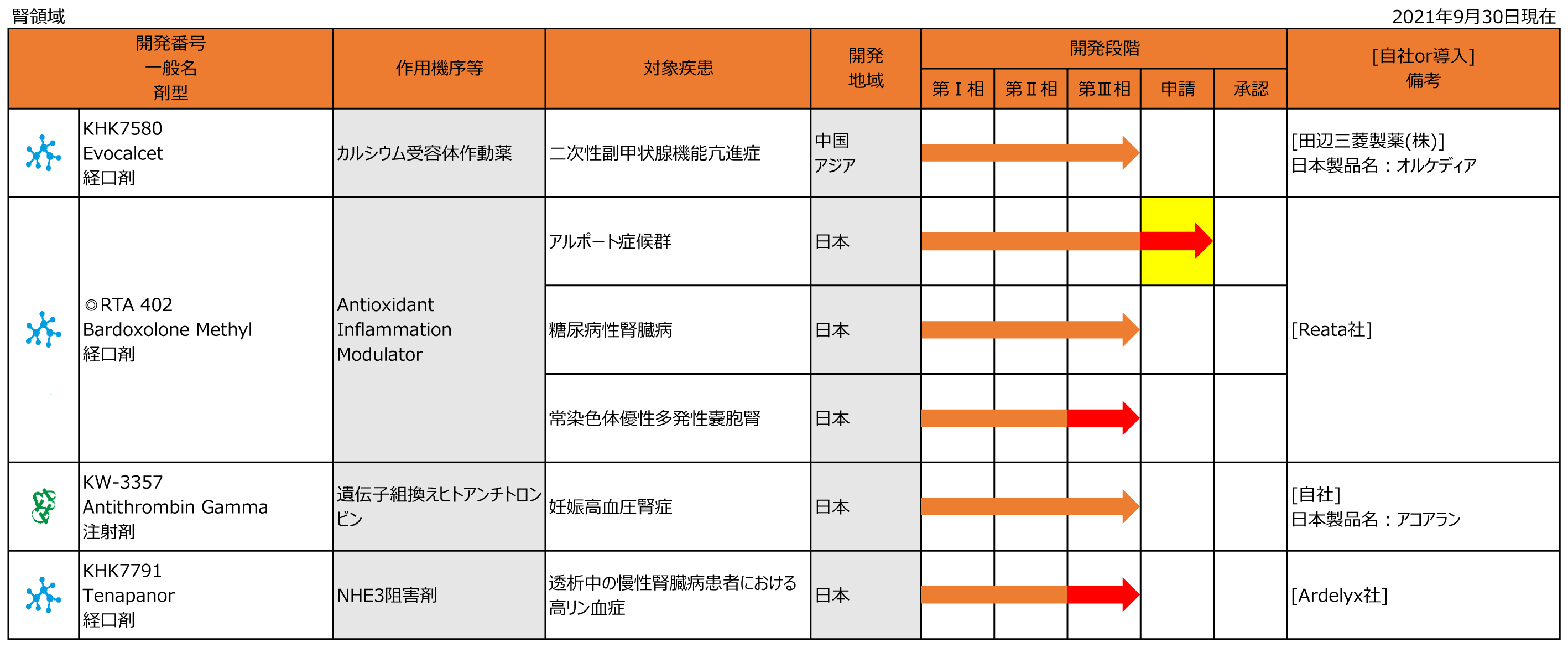
腎領域
RTA402
・1月に日本において常染色体優性多発性嚢胞腎を対象とした第Ⅲ相試験を開始しました。
◆7月に日本においてアルポート症候群を対象とした承認申請を行いました。
KHK7791
・4月に日本において血液透析および腹膜透析施行中の高リン血症を対象とした第Ⅲ相試験を開始しました。
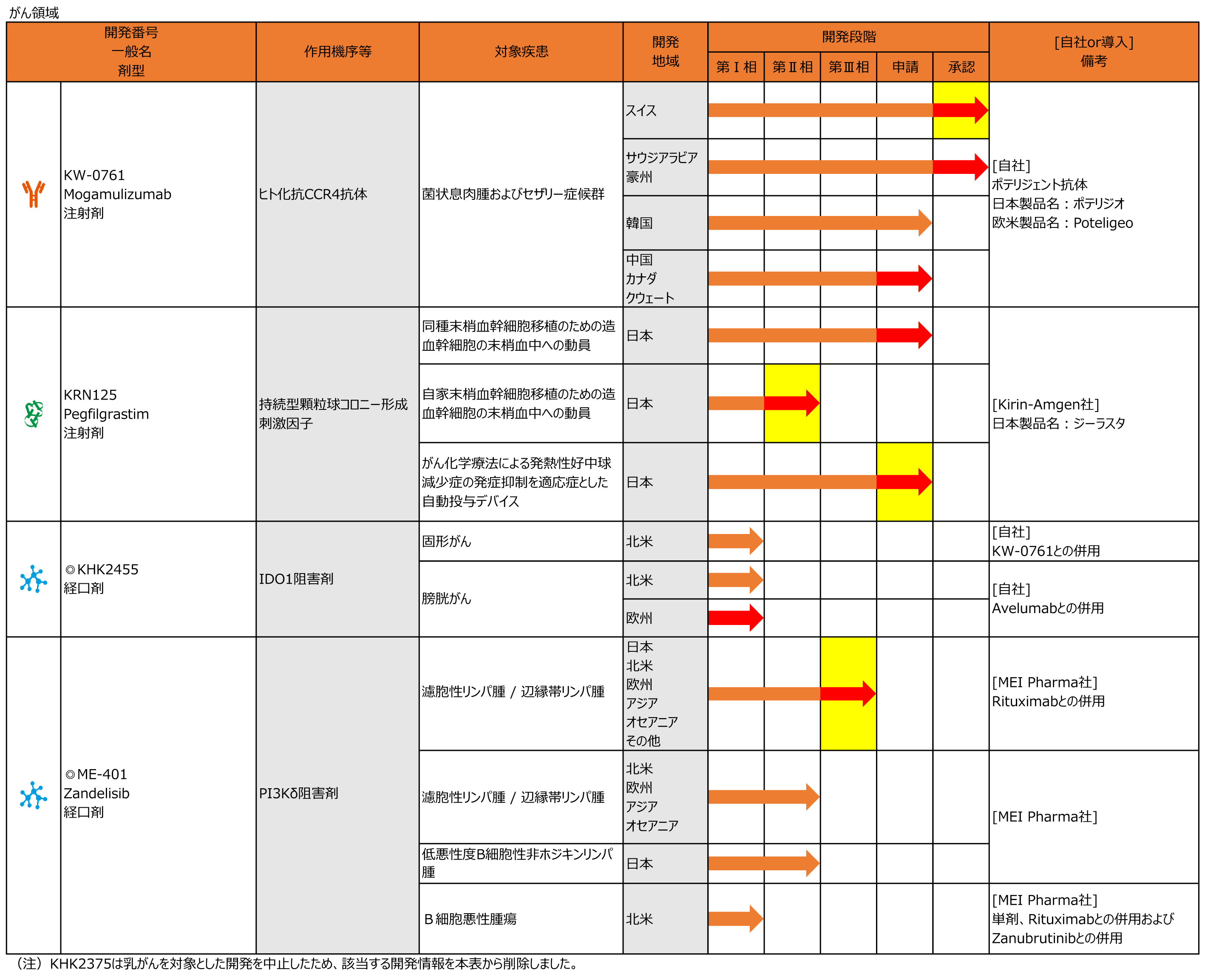
がん領域
KW-0761(日本製品名:ポテリジオ、欧米製品名:Poteligeo)
・6月に中国において菌状息肉腫およびセザリー症候群を適応症とした承認申請を行いました。
KHK2375
◆日本において乳がんを対象とした第Ⅱ相試験を実施いたしましたが、米国国立がん研究所(NCI)がスポンサーとなり進めてきたグローバル第Ⅲ相試験(E2112試験)でのエンドポイント未達を受け、国内申請の今後の可能性について検討を進めた結果、以降の開発を中止しました。
KRN125(日本製品名:ジーラスタ)
・3月に日本において同種末梢血幹細胞移植のための造血幹細胞の末梢血中への動員を適応症とした承認事項一部変更承認申請を行いました。
◆8月に日本においてがん化学療法による発熱性好中球減少症の発症抑制を適応症とした自動投与デバイスの承認申請を行いました。
◆9月に日本において自家末梢血幹細胞移植のための造血幹細胞の末梢血中への動員を対象とした第Ⅱ相試験を開始しました。
ME-401
・6月に第Ⅱ相国際共同試験において、辺縁帯リンパ腫を対象とした追加群の試験を開始しました。
◆8月に再発又は難治性の濾胞性リンパ腫および辺縁帯リンパ腫症例を対象としたリツキシマブとの併用療法の第Ⅲ相国際共同試験を開始しました。
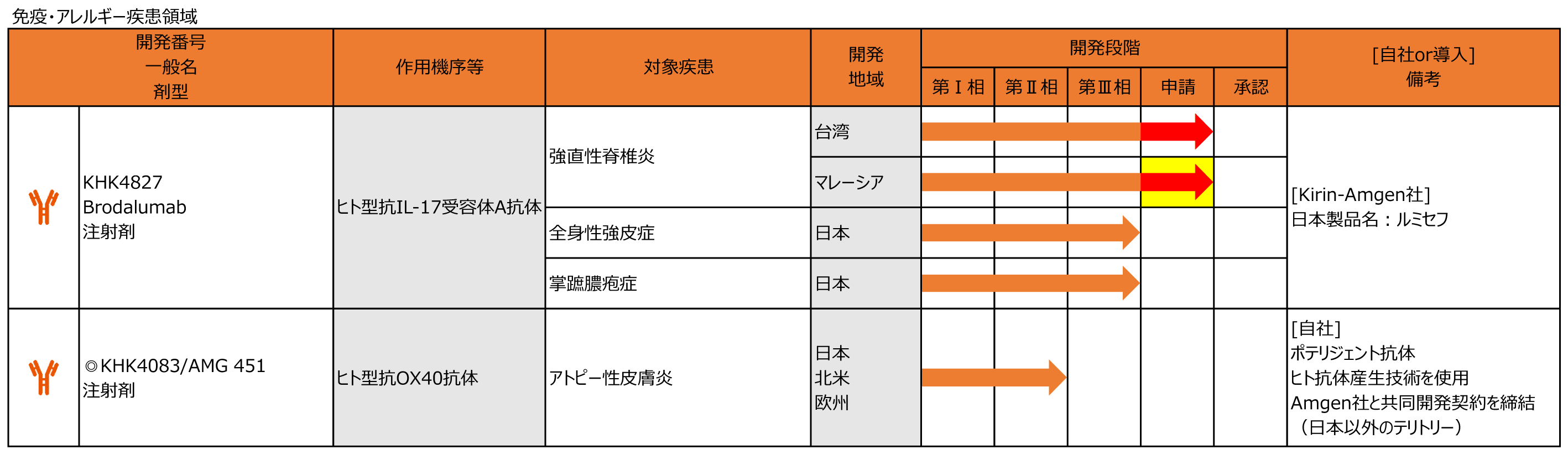
免疫・アレルギー疾患領域
KHK4083/AMG451
・6月にアムジェン社とアトピー性皮膚炎等を対象とした共同開発・販売に関する契約を締結しました。
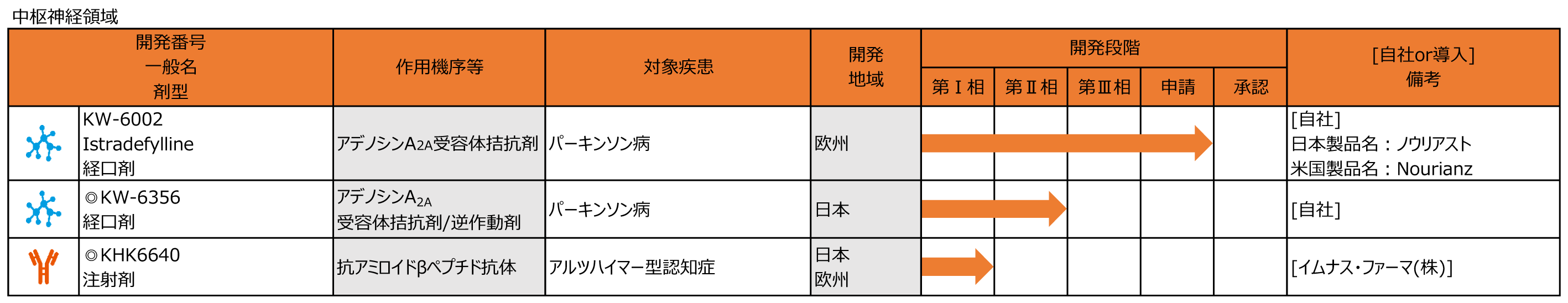
その他
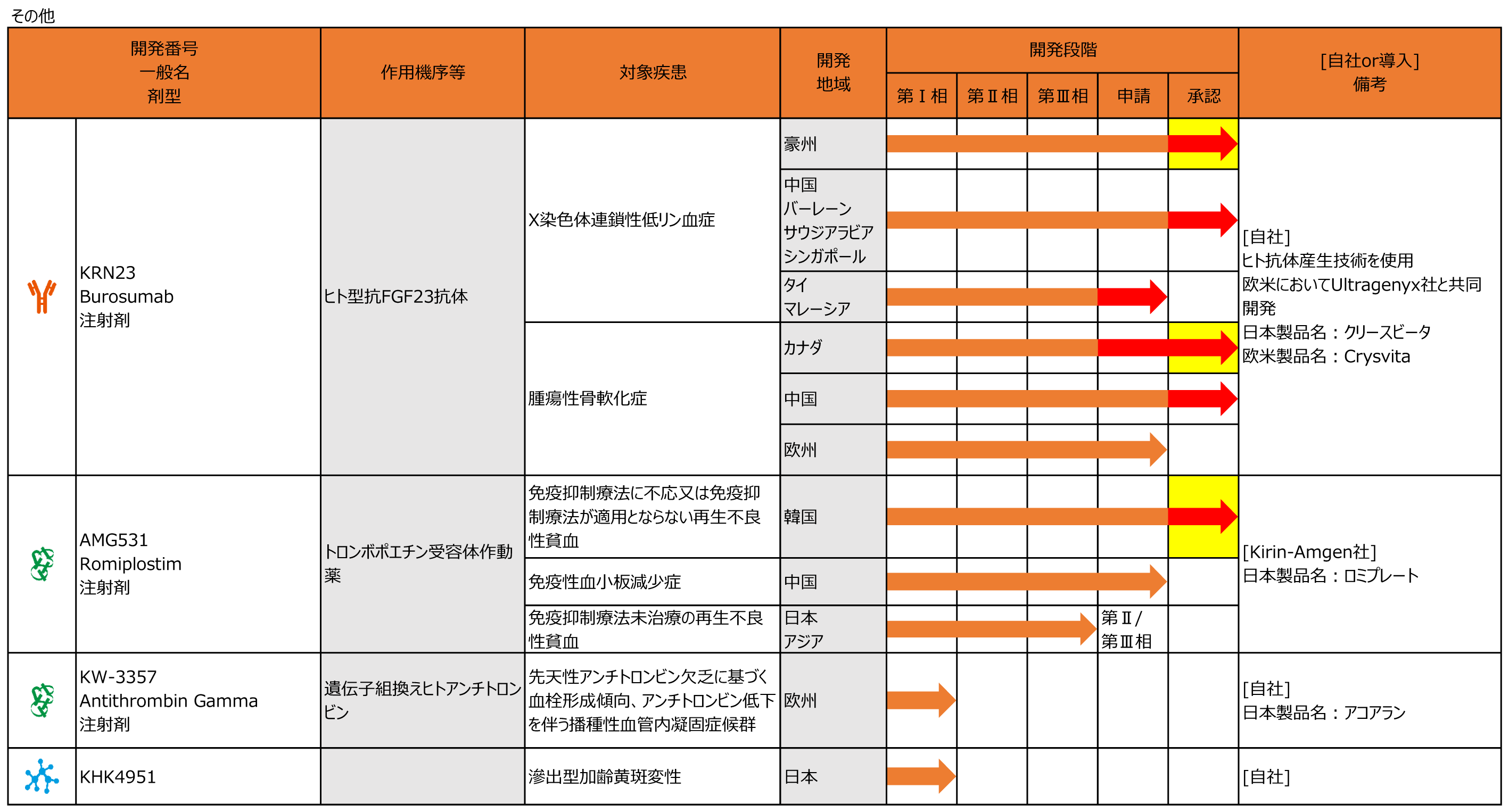
KRN23(日本製品名:クリースビータ、欧米製品名:Crysvita)
・1月に欧州において腫瘍性骨軟化症を適応症とした生物学的製剤承認一部変更申請が受理されました。(2020年12月申請)
・1月に中国においてX染色体連鎖性低リン血症性くる病・骨軟化症を適応症として承認されました。
・3月に中国において腫瘍性骨軟化症を適応症として承認されました。
AMG531(日本製品名:ロミプレート)
◆8月に韓国において免疫抑制療法に不応又は免疫抑制療法が適用とならない再生不良性貧血を適応症として承認されました。
開発パイプライン一覧