四半期報告書-第22期第2四半期(令和2年4月1日-令和2年6月30日)
(1) 経営成績の分析
当社グループ(当社、連結子会社1社及び持分法適用会社1社)は当第2四半期連結累計期間において、HGF遺伝子治療用製品を中心とする遺伝子医薬品、及び新型コロナウイルス感染症向けワクチンの研究開発を進めるとともに、戦略的提携先との共同開発を進めるなど、将来の成長を見据えた事業の深化を図ってまいりました。
当第2四半期連結累計期間の事業収益は16百万円(前年同期比1億55百万円(△90.2%)の減収)となりました。当社グループでは、提携企業からの契約一時金、マイルストーンを研究開発事業収益に計上しております。また、HGF遺伝子治療用製品「コラテジェン®筋注用4mg(以下「コラテジェン®」といいます。)」の販売収入につきまして、製品売上高に計上しております。
2019年6月をもってムコ多糖症Ⅵ型治療薬「ナグラザイム®」の販売が終了したため、当第2四半期連結累計期間において商品売上高は計上がありませんでした(前年同期は1億70百万円)。研究開発事業収益も計上がありませんでした(前年同期は2百万円)。2019年9月よりコラテジェン®の販売を開始しており、当第2四半期連結累計期間において製品売上高を16百万円計上いたしました。
当第2四半期連結累計期間における事業費用は、17億83百万円(前年同期比99百万円(△5.3%)の減少)となりました。売上原価は、9百万円(前年同期比74百万円(△89.0%)の減少)となりました。研究開発費は11億4百万円(前年同期比25百万円(△2.2%)の減少)となりました。当第2四半期連結累計期間において原材料の評価替計上額が前年同期よりも少額であったため、研究用材料費が1億22百万円減少しております。一方で、米国においてHGF遺伝子治療用製品の下肢潰瘍を有する慢性動脈閉塞症を対象とした第Ⅱb相臨床試験を開始し治験費用が発生したこと、及び新型コロナウイルス感染症向けワクチン開発に伴い、外注費が90百万円増加しております。当社グループのような研究開発型バイオベンチャー企業にとって研究開発は生命線でありますので、提携戦略により財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4)研究開発活動」をご参照ください。
当第2四半期連結累計期間における販売費及び一般管理費は6億68百万円(前年同期比0百万円(+0.1%)の増加)となりました。前年同期と比較して、法人事業税の資本割額が増加したことにより、租税公課が36百万円増加しております。また、新型コロナ感染症拡大による出張の自粛等により、旅費交通費が15百万円減少しております。
この結果、当第2四半期連結累計期間の営業損失は17億66百万円(前年同期の営業損失は17億9百万円)となり、前年同期より56百万円損失が拡大しております。
当第2四半期連結累計期間の経常損失は、18億96百万円(前年同期の経常損失は17億33百万円)となりました。外貨預金の評価替に伴い、為替差益が36百万円発生しております。新株予約権の発行及び行使に伴う株式交付費が58百万円発生し、前年同期に比べ23百万円増加しております。当第2四半期連結会計累計期間よりEmendo Biotherapeutics Inc.(以下「Emendo社」といいます。)が持分法適用会社となり、持分法による投資損失が1億20百万円発生しております。
当第2四半期連結累計期間の親会社株主に帰属する四半期純損失は、18億96百万円(前年同期の親会社株主に帰属する四半期純損失は19億73百万円)となりました。ストック・オプションの権利行使期間終了による権利失効に伴い、新株予約権戻入益が5百万円発生しております。前年同期においては、投資有価証券評価損を2億43百万円計上しておりましたが、当第2四半期連結累計期間においては発生しておりません。
(2) 財政状態の分析
当第2四半期連結会計期間末の総資産は220億99百万円(前連結会計年度末比95億74百万円の増加)となりました。新株予約権の発行及び行使に伴う114億69百万円の入金はありましたが、Emendo社株式の取得及び当期事業費用への充当により、現金及び預金は35億12百万円増加し135億52百万円となりました。主に新型コロナウイルス感染症向けワクチンの製造に係る費用を前払いしたことに伴い、前渡金が7億1百万円増加しております。流動資産は42億8百万円増加し152億円となりました。
投資その他の資産においては、Emendo社株式の取得により投資有価証券が52億85百万円増加し、67億4百万円となりました。これにより、固定資産は53億65百万円増加し、68億98百万円となっております。
当第2四半期連結会計期間末の負債は4億37百万円(前連結会計年度末比32百万円の減少)となりました。
純資産は216億62百万円(前連結会計年度末比96億6百万円の増加)となりました。新株予約権の発行及び行使により、資本金及び資本剰余金がそれぞれ57億44百万円増加し、新株予約権が54百万円増加しております。保有する有価証券の評価差額を計上したことに伴い、その他有価証券評価差額金が11百万円減少しております。親会社株主に帰属する四半期純損失18億96百万円の計上により、利益剰余金が減少しております。
(3) キャッシュ・フローの状況
当第2四半期連結会計期間末における現金及び現金同等物(以下、「資金」といいます。)は、前連結会計年度末に比べ35億12百万円増加し、135億52百万円となりました。当第2四半期連結累計期間のキャッシュ・フローの状況は次のとおりです。
(営業活動によるキャッシュ・フロー)
当第2四半期連結累計期間における営業活動による資金の減少は、24億12百万円(前年同期は10億67百万円の減少)となりました。未収消費税が36百万円減少し、仕入債務が23百万増加しましたが、税金等調整前四半期純損失18億90百万円に加え、前渡金が7億1百万円増加し、未払金が28百万円、その他の流動負債が35百万円減少しております。その結果、前年同期と比べ、13億45百万円の支出増加となっております。
(投資活動によるキャッシュ・フロー)
当第2四半期連結累計期間における投資活動による資金の減少は、55億25百万円(前年同期は11億10百万円の減少)となりました。Emendo社株式の取得により、投資有価証券の取得による支出54億41百万円が発生しております。
(財務活動によるキャッシュ・フロー)
当第2四半期連結累計期間における財務活動による資金の増加は、114億14百万円(前年同期は76億83百万円の増加)となりました。新株予約権の行使による株式の発行による収入が113億41百万円発生しております。
(4) 研究開発活動
当第2四半期連結累計期間の研究開発費の総額は11億4百万円であります。
当社グループでは、以下のプロジェクトを中心に研究開発を進めました。
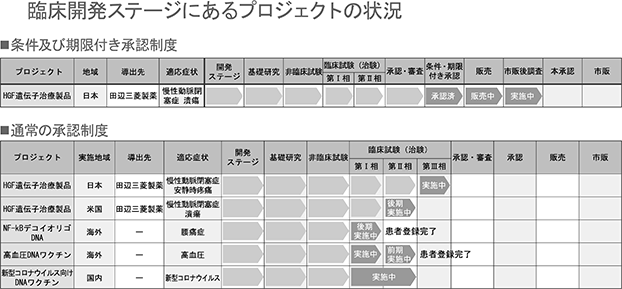
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド、開発コード:AMG0001)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2018年1月に厚生労働省に対し再生医療等製品の製造販売承認申請を行い、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症の潰瘍の改善効能効果で条件及び期限付承認を取得し、同年9月より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本国内及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、2024年3月には本承認取得を目指してまいります。
また、この「コラテジェン®」の適応拡大を目的として、慢性動脈閉塞症の安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より開始しております。試験期間は約2年間で、症例数は約40例を予定しています。
海外での開発については、米国において2020年より、下肢潰瘍を有する慢性動脈閉塞症を対象とした第Ⅱb相臨床試験を開始いたしました。また、2019年2月にイスラエルにおけるHGF遺伝子治療用製品「コラテジェン®」の独占的販売権の許諾について同国Kamada社と基本合意書を締結しております。現在は、Kamada社がイスラエル当局と実用化に向けた討議を行っています。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(開発コード:AMG0103) (自社品)⦆
NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めています。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験を実施し、2020年2月に予定した25例の患者投与が完了いたしました。
⦅その他⦆
デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイの研究を行ってきましたが、NF-κBとSTAT6という2つの転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイに比べ、炎症を抑える効果が格段に高いことが期待されます。
■高血圧DNAワクチン(開発コード:AGMG0201)(自社品)
当社は、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、最初の開発品として高血圧DNAワクチンの開発を進めております。2018年4月より第Ⅰ/Ⅱa相臨床試験を実施し、2020年3月に予定していた24例の患者投与が完了いたしました。
■Vasomune社との提携
当社は、2018年7月にVasomune社と全世界を対象とし、急性呼吸不全など過度の浮腫を原因とする疾患に対する医薬品に関する共同開発に合意、契約締結したことを発表いたしました。現在、非臨床段階の共同開発を進めております。
■新型コロナウイルス感染症向けワクチン開発
新型コロナウイルス感染症の全世界的な蔓延を機に、急遽予防用としてDNAワクチン開発を2020年度3月より開始しました。2020年6月30日より大阪市立大学医学部附属病院において第Ⅰ/Ⅱ相臨床試験を30症例にて開始しております。第Ⅰ/Ⅱ相臨床試験の結果をもって、より大規模な臨床試験を行い、早期の実用化へ繋げるために開発を進めております 。
(5) 事業のリスクに記載した重要事象等についての分析及び改善するための対応方法
医薬品事業は、製品化までに多額の資金と長い時間を要する等の特性があり、創薬ベンチャーである当社グループにおいては、継続的な営業損失の発生及び営業キャッシュ・フローのマイナスを計上している状況にあります。そのため、継続企業の前提に重要な疑義を生じさせるような状況が存在しております。
当社グループは当該状況を解消すべく、下記を重要な課題として取り組んでおります。
① 自社既存プロジェクトの推進と事業基盤の拡大
当社グループは慢性動脈閉塞症を対象としたHGF遺伝子治療用製品、椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンの3プロジェクトを推進しております。HGF遺伝子治療用製品「コラテジェン®」は国内初の遺伝子治療用製品として2019年3月に条件及び期限付承認を厚生労働省から取得し、同年9月より販売を開始いたしました。今後は国内での同製品の適用拡大のための臨床試験及び米国での慢性動脈閉塞症を対象とした臨床試験を進めてまいります。また、現在海外で臨床試験を進めております椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンを含めた3プロジェクトを推進しております。
これらの既存プロジェクトに加え、2020年3月より、新型コロナウイルス感染症向けワクチンを大阪大学と共同開発に着手いたしました。さらに、ライセンス導入や共同開発、創薬プラットフォーム技術の獲得を目指した事業提携に加え、他社に対する一部資本参加や他社の買収等により開発品パイプラインの拡充による事業基盤の拡大を図り、将来の成長を実現してまいります。
② 開発プロジェクトにおける提携先の確保
当社グループでは、開発プロジェクトのリスクを低減するために、製薬会社と提携し、契約金・マイルストーンや開発協力金を受け取ることにより財務リスクを低減しながら開発を進めるという提携モデルを基本方針としております。
「コラテジェン®」については、米国と日本を対象とした独占的販売契約を田辺三菱製薬株式会社と締結しており、マイルストーン収入やロイヤリティ収入が見込めます。また、椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンにつきましては臨床試験を実施しており、良好な結果が得られましたら早期に製薬企業等に導出することで契約一時金等を得ることにより開発費の負担削減を目指してまいります。
今後も、製薬会社との提携を進めることにより、事業基盤の強化に努めてまいります。
③ 資金調達の実施
2020年3月4日に発行したフィリップ証券株式会社を割当先とする第37回新株予約権(第三者割当て)について当第2四半期連結累計期間において全数が行使され114億69百万円(新株予約権発行による入金含む)を調達いたしました。
これら諸施策の実施により、継続企業の前提に関する重要な不確実性は認められないと判断しております。
当社グループ(当社、連結子会社1社及び持分法適用会社1社)は当第2四半期連結累計期間において、HGF遺伝子治療用製品を中心とする遺伝子医薬品、及び新型コロナウイルス感染症向けワクチンの研究開発を進めるとともに、戦略的提携先との共同開発を進めるなど、将来の成長を見据えた事業の深化を図ってまいりました。
当第2四半期連結累計期間の事業収益は16百万円(前年同期比1億55百万円(△90.2%)の減収)となりました。当社グループでは、提携企業からの契約一時金、マイルストーンを研究開発事業収益に計上しております。また、HGF遺伝子治療用製品「コラテジェン®筋注用4mg(以下「コラテジェン®」といいます。)」の販売収入につきまして、製品売上高に計上しております。
2019年6月をもってムコ多糖症Ⅵ型治療薬「ナグラザイム®」の販売が終了したため、当第2四半期連結累計期間において商品売上高は計上がありませんでした(前年同期は1億70百万円)。研究開発事業収益も計上がありませんでした(前年同期は2百万円)。2019年9月よりコラテジェン®の販売を開始しており、当第2四半期連結累計期間において製品売上高を16百万円計上いたしました。
当第2四半期連結累計期間における事業費用は、17億83百万円(前年同期比99百万円(△5.3%)の減少)となりました。売上原価は、9百万円(前年同期比74百万円(△89.0%)の減少)となりました。研究開発費は11億4百万円(前年同期比25百万円(△2.2%)の減少)となりました。当第2四半期連結累計期間において原材料の評価替計上額が前年同期よりも少額であったため、研究用材料費が1億22百万円減少しております。一方で、米国においてHGF遺伝子治療用製品の下肢潰瘍を有する慢性動脈閉塞症を対象とした第Ⅱb相臨床試験を開始し治験費用が発生したこと、及び新型コロナウイルス感染症向けワクチン開発に伴い、外注費が90百万円増加しております。当社グループのような研究開発型バイオベンチャー企業にとって研究開発は生命線でありますので、提携戦略により財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4)研究開発活動」をご参照ください。
当第2四半期連結累計期間における販売費及び一般管理費は6億68百万円(前年同期比0百万円(+0.1%)の増加)となりました。前年同期と比較して、法人事業税の資本割額が増加したことにより、租税公課が36百万円増加しております。また、新型コロナ感染症拡大による出張の自粛等により、旅費交通費が15百万円減少しております。
この結果、当第2四半期連結累計期間の営業損失は17億66百万円(前年同期の営業損失は17億9百万円)となり、前年同期より56百万円損失が拡大しております。
当第2四半期連結累計期間の経常損失は、18億96百万円(前年同期の経常損失は17億33百万円)となりました。外貨預金の評価替に伴い、為替差益が36百万円発生しております。新株予約権の発行及び行使に伴う株式交付費が58百万円発生し、前年同期に比べ23百万円増加しております。当第2四半期連結会計累計期間よりEmendo Biotherapeutics Inc.(以下「Emendo社」といいます。)が持分法適用会社となり、持分法による投資損失が1億20百万円発生しております。
当第2四半期連結累計期間の親会社株主に帰属する四半期純損失は、18億96百万円(前年同期の親会社株主に帰属する四半期純損失は19億73百万円)となりました。ストック・オプションの権利行使期間終了による権利失効に伴い、新株予約権戻入益が5百万円発生しております。前年同期においては、投資有価証券評価損を2億43百万円計上しておりましたが、当第2四半期連結累計期間においては発生しておりません。
(2) 財政状態の分析
当第2四半期連結会計期間末の総資産は220億99百万円(前連結会計年度末比95億74百万円の増加)となりました。新株予約権の発行及び行使に伴う114億69百万円の入金はありましたが、Emendo社株式の取得及び当期事業費用への充当により、現金及び預金は35億12百万円増加し135億52百万円となりました。主に新型コロナウイルス感染症向けワクチンの製造に係る費用を前払いしたことに伴い、前渡金が7億1百万円増加しております。流動資産は42億8百万円増加し152億円となりました。
投資その他の資産においては、Emendo社株式の取得により投資有価証券が52億85百万円増加し、67億4百万円となりました。これにより、固定資産は53億65百万円増加し、68億98百万円となっております。
当第2四半期連結会計期間末の負債は4億37百万円(前連結会計年度末比32百万円の減少)となりました。
純資産は216億62百万円(前連結会計年度末比96億6百万円の増加)となりました。新株予約権の発行及び行使により、資本金及び資本剰余金がそれぞれ57億44百万円増加し、新株予約権が54百万円増加しております。保有する有価証券の評価差額を計上したことに伴い、その他有価証券評価差額金が11百万円減少しております。親会社株主に帰属する四半期純損失18億96百万円の計上により、利益剰余金が減少しております。
(3) キャッシュ・フローの状況
当第2四半期連結会計期間末における現金及び現金同等物(以下、「資金」といいます。)は、前連結会計年度末に比べ35億12百万円増加し、135億52百万円となりました。当第2四半期連結累計期間のキャッシュ・フローの状況は次のとおりです。
(営業活動によるキャッシュ・フロー)
当第2四半期連結累計期間における営業活動による資金の減少は、24億12百万円(前年同期は10億67百万円の減少)となりました。未収消費税が36百万円減少し、仕入債務が23百万増加しましたが、税金等調整前四半期純損失18億90百万円に加え、前渡金が7億1百万円増加し、未払金が28百万円、その他の流動負債が35百万円減少しております。その結果、前年同期と比べ、13億45百万円の支出増加となっております。
(投資活動によるキャッシュ・フロー)
当第2四半期連結累計期間における投資活動による資金の減少は、55億25百万円(前年同期は11億10百万円の減少)となりました。Emendo社株式の取得により、投資有価証券の取得による支出54億41百万円が発生しております。
(財務活動によるキャッシュ・フロー)
当第2四半期連結累計期間における財務活動による資金の増加は、114億14百万円(前年同期は76億83百万円の増加)となりました。新株予約権の行使による株式の発行による収入が113億41百万円発生しております。
(4) 研究開発活動
当第2四半期連結累計期間の研究開発費の総額は11億4百万円であります。
当社グループでは、以下のプロジェクトを中心に研究開発を進めました。
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド、開発コード:AMG0001)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2018年1月に厚生労働省に対し再生医療等製品の製造販売承認申請を行い、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症の潰瘍の改善効能効果で条件及び期限付承認を取得し、同年9月より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本国内及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、2024年3月には本承認取得を目指してまいります。
また、この「コラテジェン®」の適応拡大を目的として、慢性動脈閉塞症の安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より開始しております。試験期間は約2年間で、症例数は約40例を予定しています。
海外での開発については、米国において2020年より、下肢潰瘍を有する慢性動脈閉塞症を対象とした第Ⅱb相臨床試験を開始いたしました。また、2019年2月にイスラエルにおけるHGF遺伝子治療用製品「コラテジェン®」の独占的販売権の許諾について同国Kamada社と基本合意書を締結しております。現在は、Kamada社がイスラエル当局と実用化に向けた討議を行っています。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(開発コード:AMG0103) (自社品)⦆
NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めています。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験を実施し、2020年2月に予定した25例の患者投与が完了いたしました。
⦅その他⦆
デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイの研究を行ってきましたが、NF-κBとSTAT6という2つの転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイに比べ、炎症を抑える効果が格段に高いことが期待されます。
■高血圧DNAワクチン(開発コード:AGMG0201)(自社品)
当社は、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、最初の開発品として高血圧DNAワクチンの開発を進めております。2018年4月より第Ⅰ/Ⅱa相臨床試験を実施し、2020年3月に予定していた24例の患者投与が完了いたしました。
■Vasomune社との提携
当社は、2018年7月にVasomune社と全世界を対象とし、急性呼吸不全など過度の浮腫を原因とする疾患に対する医薬品に関する共同開発に合意、契約締結したことを発表いたしました。現在、非臨床段階の共同開発を進めております。
■新型コロナウイルス感染症向けワクチン開発
新型コロナウイルス感染症の全世界的な蔓延を機に、急遽予防用としてDNAワクチン開発を2020年度3月より開始しました。2020年6月30日より大阪市立大学医学部附属病院において第Ⅰ/Ⅱ相臨床試験を30症例にて開始しております。第Ⅰ/Ⅱ相臨床試験の結果をもって、より大規模な臨床試験を行い、早期の実用化へ繋げるために開発を進めております 。

(5) 事業のリスクに記載した重要事象等についての分析及び改善するための対応方法
医薬品事業は、製品化までに多額の資金と長い時間を要する等の特性があり、創薬ベンチャーである当社グループにおいては、継続的な営業損失の発生及び営業キャッシュ・フローのマイナスを計上している状況にあります。そのため、継続企業の前提に重要な疑義を生じさせるような状況が存在しております。
当社グループは当該状況を解消すべく、下記を重要な課題として取り組んでおります。
① 自社既存プロジェクトの推進と事業基盤の拡大
当社グループは慢性動脈閉塞症を対象としたHGF遺伝子治療用製品、椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンの3プロジェクトを推進しております。HGF遺伝子治療用製品「コラテジェン®」は国内初の遺伝子治療用製品として2019年3月に条件及び期限付承認を厚生労働省から取得し、同年9月より販売を開始いたしました。今後は国内での同製品の適用拡大のための臨床試験及び米国での慢性動脈閉塞症を対象とした臨床試験を進めてまいります。また、現在海外で臨床試験を進めております椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンを含めた3プロジェクトを推進しております。
これらの既存プロジェクトに加え、2020年3月より、新型コロナウイルス感染症向けワクチンを大阪大学と共同開発に着手いたしました。さらに、ライセンス導入や共同開発、創薬プラットフォーム技術の獲得を目指した事業提携に加え、他社に対する一部資本参加や他社の買収等により開発品パイプラインの拡充による事業基盤の拡大を図り、将来の成長を実現してまいります。
② 開発プロジェクトにおける提携先の確保
当社グループでは、開発プロジェクトのリスクを低減するために、製薬会社と提携し、契約金・マイルストーンや開発協力金を受け取ることにより財務リスクを低減しながら開発を進めるという提携モデルを基本方針としております。
「コラテジェン®」については、米国と日本を対象とした独占的販売契約を田辺三菱製薬株式会社と締結しており、マイルストーン収入やロイヤリティ収入が見込めます。また、椎間板性腰痛症向けの核酸医薬(NF-κBデコイオリゴDNA)、高血圧DNAワクチンにつきましては臨床試験を実施しており、良好な結果が得られましたら早期に製薬企業等に導出することで契約一時金等を得ることにより開発費の負担削減を目指してまいります。
今後も、製薬会社との提携を進めることにより、事業基盤の強化に努めてまいります。
③ 資金調達の実施
2020年3月4日に発行したフィリップ証券株式会社を割当先とする第37回新株予約権(第三者割当て)について当第2四半期連結累計期間において全数が行使され114億69百万円(新株予約権発行による入金含む)を調達いたしました。
これら諸施策の実施により、継続企業の前提に関する重要な不確実性は認められないと判断しております。