四半期報告書-第23期第3四半期(令和3年7月1日-令和3年9月30日)
(1) 経営成績の分析
当社グループ(当社及び連結子会社3社)は当第3四半期連結累計期間において、新型コロナウイルス感染症に対する予防用ワクチンと治療薬の二軸で国内外において開発を進めております。HGF遺伝子治療用製品「コラテジェン®」は適用拡大及び米国での承認を目指して、国内外で臨床試験を進めております。また、新規ゲノム編集技術を有するEmendoBio Inc.(以下Emendo社といいます。)を完全子会社化し、戦略的提携先との共同開発を進めて開発パイプラインの拡充を図り、遺伝子医薬のグローバルリーダーを目指した事業を推進してまいりました。
2020年12月に子会社化したEmendo社の業績は当第3四半期連結累計期間より連結損益計算書に含めております。
当第3四半期連結累計期間の事業収益は44百万円(前年同期比16百万円(+56.9%)の増収)となりました。当社グループでは、HGF遺伝子治療用製品「コラテジェン®筋注用4mg(以下「コラテジェン®」といいます。)」の販売収入につきまして、製品売上高に計上しております。4月に開設した衛生検査所において希少遺伝性疾患検査のオプショナルスクリーニング検査を実施しており、手数料収入に計上しております。当第3四半期連結累計期間において、製品売上高30百万円(前年同期比2百万円(+8.6%)の増収)、手数料収入13百万円(前年同期比13百万円の増収)を計上いたしました。
当第3四半期連結累計期間における事業費用は、122億7百万円(前年同期比93億21百万円(+323.0%)の増加)となりました。
売上原価は、39百万円(前年同期比23百万円(+144.5%)の増加)となりました。当第3四半期連結累計期間より、衛生検査所における希少遺伝性疾患検査オプショナルスクリーニングの売上原価を計上しております。
研究開発費は84億90百万円(前年同期比66億9百万円(+351.4%)の増加)となりました。当第3四半期連結累計期間において、主に新型コロナウイルス感染症予防DNAワクチンの原材料を臨床試験及び非臨床試験へ使用したことにより、研究用材料費が15億2百万円増加しております。新型コロナウイルス感染症予防DNAワクチンの臨床試験及び非臨床試験の進展により、外注費が35億26百万円増加しております。新型コロナウイルス感染症予防DNAワクチンの研究用試薬・消耗品の購入及び衛生検査所開設に伴う測定機器・試薬等の購入により、消耗品費が2億92百万円増加しております。主にEmendo社を連結子会社化したことにより、給料手当が3億90百万円増加しております。当社グループのような研究開発型バイオベンチャー企業は先行投資が続きますが、提携戦略などにより財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4)研究開発活動」をご参照ください。
当第3四半期連結累計期間における販売費及び一般管理費は36億78百万円(前年同期比26億88百万円(+271.7%)の増加)となりました。前年同期と比較して、主に弁護士等専門家への報酬の増額、コンサルタント費用の増加、銀行手数料の増加等により、支払手数料が4億7百万円増加しております。また、のれん償却費が17億83百万円発生しております。
この結果、当第3四半期連結累計期間の営業損失は121億63百万円(前年同期の営業損失は28億57百万円)となり、前年同期より93億5百万円損失が拡大しております。
当第3四半期連結累計期間の経常損失は、118億23百万円(前年同期の経常損失は31億50百万円)となりました。外貨預金及びEmendo社への貸付金の評価替に伴い、為替差益が3億69百万円発生しております。Vasomune Therapeutics, Inc.(以下Vasomune社といいます。)が米国及びカナダにおいて獲得した助成金について、当社開発費負担分に応じて受領し、補助金収入に31百万円計上しております。新株予約権の発行及び行使に伴う株式交付費が96百万円発生し、前年同期に比べ28百万円増加しております。前年同期において、Emendo社を持分法適用会社としたことに伴い持分法による投資損失2億63百万円を計上しておりましたが、当期においては発生しておりません。
当第3四半期連結累計期間の親会社株主に帰属する四半期純損失は、119億52百万円(前年同期の親会社株主に帰属する四半期純損失は31億74百万円)となりました。ストック・オプションの権利行使期間終了による権利失効に伴い、新株予約権戻入益が32百万円発生しております。Barcode Diagnostics Ltd.(以下Barcode社といいます。)株式等を減損したことにより、投資有価証券評価損が1億63百万円発生しております。
(2) 財政状態の分析
当第3四半期連結会計期間末の総資産は477億35百万円(前連結会計年度末比93億80百万円の増加)となりました。新株予約権の発行及び行使に伴う174億74百万円の入金はありましたが、当期事業費用への充当により、現金及び預金は96億3百万円増加し、211億40百万円となりました。使用期限を超過した原材料を評価替えしたことにより、原材料及び貯蔵品が1億92百万円減少しております。流動資産は95億56百万円増加し、237億23百万円となっております。
固定資産においては、のれんの償却による17億83百万円の減少の一方、円安に伴う為替換算等17億53百万円の増加により、のれんが30百万円減少して226億83百万円となりました。Barcode社株式等の評価損により、投資有価証券が1億57百万円減少しております。固定資産は1億75百万円減少し、240億12百万円となっております。
当第3四半期連結会計期間末の負債は79億21百万円(前連結会計年度末比22億46百万円の増加)となりました。前年度の費用の支払により、未払金が6億87百万円減少しております。国立研究開発法人日本医療研究開発機構(AMED)より採択された「新型コロナウイルス感染症(COVID-19)に対するワクチン開発」及び厚生労働省より採択された「ワクチン生産体制等緊急整備事業」に関する助成金が入金され、前受金が29億40百万円増加しております。
純資産は398億13百万円(前連結会計年度末比71億34百万円の増加)となりました。新株予約権の行使により、資本金及び資本剰余金をそれぞれ87億47百万円計上しております。親会社株主に帰属する四半期純損失119億52百万円を利益剰余金に計上しております。2021年3月30日開催の第22期定時株主総会において、資本準備金及び利益準備金の額の減少並びに剰余金の処分について決議し、資本準備金を158億84百万円減少、繰越利益剰余金を158億84百万円増加させ、欠損の填補に充当いたしました。これらにより、当第3四半期連結累計期間において資本金が87億47百万円増加、資本剰余金が71億12百万円減少、利益剰余金が39億31百万円増加しております。ストック・オプションの権利行使及び権利行使期間終了により、新株予約権が25百万円減少しております。のれんに係る為替換算により、為替換算調整勘定が16億円増加しております。
(3) 対処すべき課題
当第3四半期連結累計期間において、当社グループの事業上及び財務上の対処すべき課題に重要な変更、及び新たに生じた課題はありません。
(4) 研究開発活動
当第3四半期連結累計期間における研究開発費は84億90百万円(前年同期比66億9百万円(∔351.4%)の増加)となりました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子治療を中心に医薬品開発に取り組んでおります。中でも2019年末から拡大している新型コロナウイルス感染症に関しては、予防用のワクチンと治療薬の二軸で、国内外において開発を進めております。また、究極の遺伝子治療であるゲノム編集においては、先進の技術を持つEmendo社を完全子会社とし、共にゲノム編集技術を用いて、いままで治療法のなかった疾患に対する医薬品開発を進めてまいります。
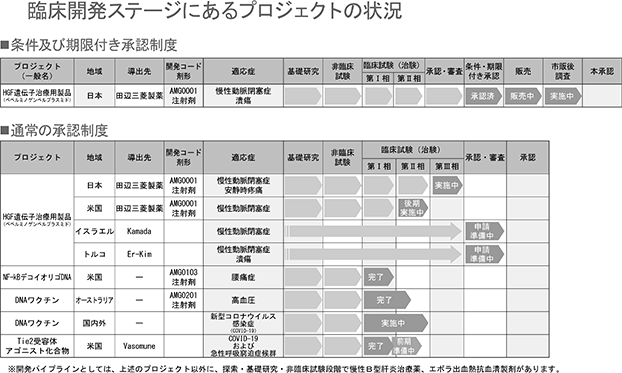
2019年9月に製品化したHGF遺伝子治療用製品「コラテジェン®」は、適応拡大及び米国での承認を目指して、国内外で臨床試験を実施しております。導出に向けた活動も積極的に行い、イスラエルのKamada社、トルコのEr-Kim社と独占的販売権許諾に関する基本合意書を締結いたしました。椎間板性腰痛症を対象としてNF-κBデコイオリゴDNAや高血圧向けDNAワクチンの開発も継続して行っております。
当社は、海外企業との提携も積極的に行い、有望な医薬品の実用化に向けて共同開発を進めております。
■新型コロナウイルス感染症予防DNAワクチン(自社品)
当社は、プラスミドDNAの技術を用いて2020年3月より大阪大学と共同で新型コロナウイルス感染症に対する予防用ワクチンの開発を開始し、これまでに30症例での第Ⅰ/Ⅱ相臨床試験および500症例での第Ⅱ/Ⅲ相臨床試験を実施しました。第Ⅰ/Ⅱ相および第Ⅱ/Ⅲ相の分析の結果、安全性において問題はなく、細胞性免疫においてある程度の上昇を確認したものの、液性免疫については期待する効果を得ることができず、今後さらに有効性を高める必要があることを確認いたしました。さらに有効性を高めるための取り組みとして、高用量製剤に絞り、臨床開発を進めてまいります。高用量製剤での第Ⅰ/Ⅱ相試験は、接種方法を筋肉注射と皮内投与の2種類とし、プラセボ(偽薬)なしの実薬のみで、目標症例数400例にて実施しております。
■新型コロナウイルス感染症治療薬(共同開発品)
当社は、カナダのバイオ医薬品企業であるVasomune社と急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品に関する共同開発契約を締結しました。現在AV-001を新型コロナウイルス感染症治療薬として、2020年12月より健康成人を対象とした第Ⅰ相臨床試験を米国において実施し、安全性と忍容性を認め、良好な結果を確認しました。現在、続く前期第Ⅱ相臨床試験の準備を進めております。
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症における潰瘍の改善の効能効果で条件及び期限付承認を取得し、2019年9月10日より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」といいます。)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、製造販売後承認条件評価を2024年までに行い、本承認取得を目指してまいります。海外開発については、米国において2020年1月より、下肢潰瘍を有する閉塞性動脈硬化症を対象とした第Ⅱb相臨床試験を実施しております。
⦅対象疾患:慢性動脈閉塞症における安静時疼痛⦆
「コラテジェン®」の適応拡大を目的として、国内において慢性動脈閉塞症における安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より実施しております。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(自社品)⦆
核酸医薬NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めております。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験は、投与後の観察期間6カ月間に続き、12ケ月間を経た結果でも、患者の忍容性は高いうえ、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛に著しい軽減とその効果の持続が認められ、有効性も確認できました。現在、第Ⅱ相臨床試験へ向けた準備を進めています。
核酸医薬デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイオリゴDNAとして、炎症に関わるNF-κBとSTAT6という2つの重要な転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイオリゴDNAと比較して、より強力で幅広い炎症抑制効果を発揮することが期待されます。
■高血圧治療用DNAワクチン(自社品)
当社グループは、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、高血圧治療用DNAワクチンの開発を進めております。オーストラリアでの第Ⅰ/Ⅱa相臨床試験は投与後の初期の試験結果の評価を行ったところ、重篤な有害事象はなく、安全性に問題がないことを確認し、アンジオテンシンⅡに対する抗体産生を認めました。分析結果は、論文としてHypertension Researchに掲載し、第43回日本高血圧学会総会Late Breaking Abstractでも発表いたしました。今後、安全性、免疫原性および有効性を評価する試験を継続的に行ってまいります。
新規研究開発プロジェクト及び新規事業プロジェクト
■ゲノム編集技術による遺伝子治療用製品開発
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社へ追加出資し、完全子会社化しました。Emendo社のゲノム編集技術は、高い効率と精度を両立したゲノム編集を可能にする画期的かつ実用的な独自技術です。現在、Emendoの希少疾患を対象とした開発プロジェクトについて、米国での臨床試験開始に向けた準備を進めています。
■希少遺伝性疾患検査を主目的とした衛生検査所開設
2021年4月に、希少遺伝性疾患検査を主目的とし、川崎生命科学・環境研究センターに衛生検査所を開設し、同年7月より、一般社団法人希少疾患の医療と研究を推進する会(CReARID)が展開する「オプショナルスクリーニング」事業の規模拡大、対象疾患の拡充をサポートする活動を開始いたしました。
■マイクロバイオームを用いた疾患予防・健康維持
当社は、腸内細菌叢を利用した疾患治療薬や健康維持のサプリメントを開発しているイスラエルのMyBiotics Pharma Ltd.と2018年7月に資本提携し、1 人 1 人の健康状態・体質に合った腸内細菌を見つけ出し、それらを含む医薬品やサプリメントを開発することを目指しています。
■Brickell Biotech,Inc.(旧:バイカル社)との戦略的な開発協力
当社と2016年12月に戦略的事業提携を締結したバイカル社は、2019年8月に米国のBrickell Biotech, Inc.との合併契約を締結し、合併後の新社名はBrickell Biotech, Inc.となりました。同社とは2020年9月に新型コロナウイルス感染症予防DNAワクチンの米国での臨床開発に関する共同開発契約を締結しました。
(5) 事業のリスクに記載した重要事象等についての分析及び改善するための対応方法
医薬品事業は、製品化までに多額の資金と長い時間を要する等の特性があり、創薬ベンチャーである当社グループにおいては、継続的な営業損失の発生及び営業キャッシュ・フローのマイナスを計上している状況にあります。そのため、継続企業の前提に重要な疑義を生じさせるような状況が存在しております。
当社グループは当該状況を解消すべく、下記を重要な課題として取り組んでおります。
①自社既存プロジェクトの推進
当社グループでは、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」の条件及び期限付承認を厚生労働省から取得し、同年9月から販売を開始いたしました。現在、製造販売後承認条件評価を行うとともに国内での同製品の適用拡大のための臨床試験及び米国での閉塞性動脈硬化症を対象とした臨床試験を進めております。また、現在海外で臨床試験を進めております椎間板性腰痛症向けの核酸医薬NF-κBデコイオリゴDNA、高血圧DNAワクチンに加え、新型コロナウイルス感染症の世界的な蔓延を機に2020年3月に開発を開始した新型コロナウイルス感染症予防DNAワクチンを含めた4プロジェクトを推進しております。これらのプロジェクトを確実に推進していくことが最優先課題であると考えております。
②開発パイプラインの拡充と事業基盤の拡大
当社グループでは新型コロナウイルス感染症の世界的な蔓延を機に予防用としてのDNAワクチンの開発を2020年3月より開始し、現在高用量製剤での第Ⅰ/Ⅱ相の臨床試験を実施しております。また、ゲノム編集における先進技術を持つEmendo社を完全子会社化し、究極の遺伝子治療ともいわれるゲノム編集で世界に戦いを挑みます。これらの開発パイプラインの拡充や事業基盤の拡大により、当社グループは遺伝子治療の世界でグローバルリーダーを目指します。
今後も、ライセンス導入や共同開発、創薬プラットフォーム技術の獲得を目指した事業提携に加え、他社に対する資本参加や他社の買収等により開発品パイプラインの拡充による事業基盤の拡大を図り、将来の成長を実現してまいります。
③開発プロジェクトにおける提携先の確保
当社グループでは、開発プロジェクトのリスクを低減するために、製薬会社と提携し、契約金・マイルストーンや開発協力金を受け取ることにより財務リスクを低減しながら開発を進めるという提携モデルを基本方針としております。
「コラテジェン®」について日本と米国を対象とした独占的販売契約を田辺三菱製薬と締結しており、マイルストーン収入やロイヤリティー収入が見込めます。また、2019年2月にイスラエルにおけるHGF遺伝子治療用製品「コラテジェン®」の独占的販売権の許諾について同国Kamada社と基本合意書を締結しております。さらに2020年10月にスペシャルティ薬(特定疾患専門薬)を扱うトルコのEr-Kim社と「コラテジェン®」のトルコでの導出(独占的販売権許諾)に関する基本合意書を締結しました。椎間板性腰痛症向けの核酸医薬NF-κBデコイオリゴDNA、高血圧DNAワクチンにつきましては臨床試験が予定どおり進捗しており、製薬企業等への早期導出により契約一時金、ロイヤリティー等を得ることにより、開発費の負担削減と定期的な収入確保を目指してまいります。今後も、製薬会社との提携を進めることにより、事業基盤の強化に努めてまいります。
④資金調達の実施
当社グループにとって、研究開発活動及び事業基盤の拡大を推進することは継続的な発展のために重要であり、そのためには状況に応じ機動的に資金調達を行うことが必要となります。2021年3月8日開催の取締役会において、第41回新株予約権(第三者割当て)(行使価額修正条項付)の発行を決議し、同年5月18日までにすべてが行使され174億74百万円(新株予約権発行による入金を含む)を調達いたしました。今後も、研究開発活動推進及び企業維持のために必要となる資金調達の可能性を適宜検討してまいります。
これら諸施策の実施により、継続企業の前提に関する重要な不確実性は認められないと判断しております。
当社グループ(当社及び連結子会社3社)は当第3四半期連結累計期間において、新型コロナウイルス感染症に対する予防用ワクチンと治療薬の二軸で国内外において開発を進めております。HGF遺伝子治療用製品「コラテジェン®」は適用拡大及び米国での承認を目指して、国内外で臨床試験を進めております。また、新規ゲノム編集技術を有するEmendoBio Inc.(以下Emendo社といいます。)を完全子会社化し、戦略的提携先との共同開発を進めて開発パイプラインの拡充を図り、遺伝子医薬のグローバルリーダーを目指した事業を推進してまいりました。
2020年12月に子会社化したEmendo社の業績は当第3四半期連結累計期間より連結損益計算書に含めております。
当第3四半期連結累計期間の事業収益は44百万円(前年同期比16百万円(+56.9%)の増収)となりました。当社グループでは、HGF遺伝子治療用製品「コラテジェン®筋注用4mg(以下「コラテジェン®」といいます。)」の販売収入につきまして、製品売上高に計上しております。4月に開設した衛生検査所において希少遺伝性疾患検査のオプショナルスクリーニング検査を実施しており、手数料収入に計上しております。当第3四半期連結累計期間において、製品売上高30百万円(前年同期比2百万円(+8.6%)の増収)、手数料収入13百万円(前年同期比13百万円の増収)を計上いたしました。
当第3四半期連結累計期間における事業費用は、122億7百万円(前年同期比93億21百万円(+323.0%)の増加)となりました。
売上原価は、39百万円(前年同期比23百万円(+144.5%)の増加)となりました。当第3四半期連結累計期間より、衛生検査所における希少遺伝性疾患検査オプショナルスクリーニングの売上原価を計上しております。
研究開発費は84億90百万円(前年同期比66億9百万円(+351.4%)の増加)となりました。当第3四半期連結累計期間において、主に新型コロナウイルス感染症予防DNAワクチンの原材料を臨床試験及び非臨床試験へ使用したことにより、研究用材料費が15億2百万円増加しております。新型コロナウイルス感染症予防DNAワクチンの臨床試験及び非臨床試験の進展により、外注費が35億26百万円増加しております。新型コロナウイルス感染症予防DNAワクチンの研究用試薬・消耗品の購入及び衛生検査所開設に伴う測定機器・試薬等の購入により、消耗品費が2億92百万円増加しております。主にEmendo社を連結子会社化したことにより、給料手当が3億90百万円増加しております。当社グループのような研究開発型バイオベンチャー企業は先行投資が続きますが、提携戦略などにより財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4)研究開発活動」をご参照ください。
当第3四半期連結累計期間における販売費及び一般管理費は36億78百万円(前年同期比26億88百万円(+271.7%)の増加)となりました。前年同期と比較して、主に弁護士等専門家への報酬の増額、コンサルタント費用の増加、銀行手数料の増加等により、支払手数料が4億7百万円増加しております。また、のれん償却費が17億83百万円発生しております。
この結果、当第3四半期連結累計期間の営業損失は121億63百万円(前年同期の営業損失は28億57百万円)となり、前年同期より93億5百万円損失が拡大しております。
当第3四半期連結累計期間の経常損失は、118億23百万円(前年同期の経常損失は31億50百万円)となりました。外貨預金及びEmendo社への貸付金の評価替に伴い、為替差益が3億69百万円発生しております。Vasomune Therapeutics, Inc.(以下Vasomune社といいます。)が米国及びカナダにおいて獲得した助成金について、当社開発費負担分に応じて受領し、補助金収入に31百万円計上しております。新株予約権の発行及び行使に伴う株式交付費が96百万円発生し、前年同期に比べ28百万円増加しております。前年同期において、Emendo社を持分法適用会社としたことに伴い持分法による投資損失2億63百万円を計上しておりましたが、当期においては発生しておりません。
当第3四半期連結累計期間の親会社株主に帰属する四半期純損失は、119億52百万円(前年同期の親会社株主に帰属する四半期純損失は31億74百万円)となりました。ストック・オプションの権利行使期間終了による権利失効に伴い、新株予約権戻入益が32百万円発生しております。Barcode Diagnostics Ltd.(以下Barcode社といいます。)株式等を減損したことにより、投資有価証券評価損が1億63百万円発生しております。
(2) 財政状態の分析
当第3四半期連結会計期間末の総資産は477億35百万円(前連結会計年度末比93億80百万円の増加)となりました。新株予約権の発行及び行使に伴う174億74百万円の入金はありましたが、当期事業費用への充当により、現金及び預金は96億3百万円増加し、211億40百万円となりました。使用期限を超過した原材料を評価替えしたことにより、原材料及び貯蔵品が1億92百万円減少しております。流動資産は95億56百万円増加し、237億23百万円となっております。
固定資産においては、のれんの償却による17億83百万円の減少の一方、円安に伴う為替換算等17億53百万円の増加により、のれんが30百万円減少して226億83百万円となりました。Barcode社株式等の評価損により、投資有価証券が1億57百万円減少しております。固定資産は1億75百万円減少し、240億12百万円となっております。
当第3四半期連結会計期間末の負債は79億21百万円(前連結会計年度末比22億46百万円の増加)となりました。前年度の費用の支払により、未払金が6億87百万円減少しております。国立研究開発法人日本医療研究開発機構(AMED)より採択された「新型コロナウイルス感染症(COVID-19)に対するワクチン開発」及び厚生労働省より採択された「ワクチン生産体制等緊急整備事業」に関する助成金が入金され、前受金が29億40百万円増加しております。
純資産は398億13百万円(前連結会計年度末比71億34百万円の増加)となりました。新株予約権の行使により、資本金及び資本剰余金をそれぞれ87億47百万円計上しております。親会社株主に帰属する四半期純損失119億52百万円を利益剰余金に計上しております。2021年3月30日開催の第22期定時株主総会において、資本準備金及び利益準備金の額の減少並びに剰余金の処分について決議し、資本準備金を158億84百万円減少、繰越利益剰余金を158億84百万円増加させ、欠損の填補に充当いたしました。これらにより、当第3四半期連結累計期間において資本金が87億47百万円増加、資本剰余金が71億12百万円減少、利益剰余金が39億31百万円増加しております。ストック・オプションの権利行使及び権利行使期間終了により、新株予約権が25百万円減少しております。のれんに係る為替換算により、為替換算調整勘定が16億円増加しております。
(3) 対処すべき課題
当第3四半期連結累計期間において、当社グループの事業上及び財務上の対処すべき課題に重要な変更、及び新たに生じた課題はありません。
(4) 研究開発活動
当第3四半期連結累計期間における研究開発費は84億90百万円(前年同期比66億9百万円(∔351.4%)の増加)となりました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子治療を中心に医薬品開発に取り組んでおります。中でも2019年末から拡大している新型コロナウイルス感染症に関しては、予防用のワクチンと治療薬の二軸で、国内外において開発を進めております。また、究極の遺伝子治療であるゲノム編集においては、先進の技術を持つEmendo社を完全子会社とし、共にゲノム編集技術を用いて、いままで治療法のなかった疾患に対する医薬品開発を進めてまいります。
2019年9月に製品化したHGF遺伝子治療用製品「コラテジェン®」は、適応拡大及び米国での承認を目指して、国内外で臨床試験を実施しております。導出に向けた活動も積極的に行い、イスラエルのKamada社、トルコのEr-Kim社と独占的販売権許諾に関する基本合意書を締結いたしました。椎間板性腰痛症を対象としてNF-κBデコイオリゴDNAや高血圧向けDNAワクチンの開発も継続して行っております。
当社は、海外企業との提携も積極的に行い、有望な医薬品の実用化に向けて共同開発を進めております。

■新型コロナウイルス感染症予防DNAワクチン(自社品)
当社は、プラスミドDNAの技術を用いて2020年3月より大阪大学と共同で新型コロナウイルス感染症に対する予防用ワクチンの開発を開始し、これまでに30症例での第Ⅰ/Ⅱ相臨床試験および500症例での第Ⅱ/Ⅲ相臨床試験を実施しました。第Ⅰ/Ⅱ相および第Ⅱ/Ⅲ相の分析の結果、安全性において問題はなく、細胞性免疫においてある程度の上昇を確認したものの、液性免疫については期待する効果を得ることができず、今後さらに有効性を高める必要があることを確認いたしました。さらに有効性を高めるための取り組みとして、高用量製剤に絞り、臨床開発を進めてまいります。高用量製剤での第Ⅰ/Ⅱ相試験は、接種方法を筋肉注射と皮内投与の2種類とし、プラセボ(偽薬)なしの実薬のみで、目標症例数400例にて実施しております。
■新型コロナウイルス感染症治療薬(共同開発品)
当社は、カナダのバイオ医薬品企業であるVasomune社と急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品に関する共同開発契約を締結しました。現在AV-001を新型コロナウイルス感染症治療薬として、2020年12月より健康成人を対象とした第Ⅰ相臨床試験を米国において実施し、安全性と忍容性を認め、良好な結果を確認しました。現在、続く前期第Ⅱ相臨床試験の準備を進めております。
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
⦅対象疾患:慢性動脈閉塞症⦆
慢性動脈閉塞症を対象疾患としたHGF遺伝子治療用製品の開発については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」により再生医療等製品の早期実用化を目的とした「条件及び期限付承認制度」(2014年11月施行)を活用し、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」として、慢性動脈閉塞症における潰瘍の改善の効能効果で条件及び期限付承認を取得し、2019年9月10日より発売を開始いたしました。
田辺三菱製薬株式会社(以下「田辺三菱製薬」といいます。)と当社は、HGF遺伝子治療用製品「コラテジェン®」の販売に関し、日本及び米国における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当いたしております。今回の承認は、条件及び期限付であり、製造販売後承認条件評価を2024年までに行い、本承認取得を目指してまいります。海外開発については、米国において2020年1月より、下肢潰瘍を有する閉塞性動脈硬化症を対象とした第Ⅱb相臨床試験を実施しております。
⦅対象疾患:慢性動脈閉塞症における安静時疼痛⦆
「コラテジェン®」の適応拡大を目的として、国内において慢性動脈閉塞症における安静時疼痛を有する患者を対象にした第Ⅲ相臨床試験を2019年10月より実施しております。
■NF-κBデコイオリゴDNA
⦅対象疾患:椎間板性腰痛症(自社品)⦆
核酸医薬NF-κBデコイオリゴDNAについては椎間板性腰痛症を含む腰痛疾患を適応症とした開発を進めております。2018年2月より椎間板性腰痛症を対象とした第Ⅰb相臨床試験は、投与後の観察期間6カ月間に続き、12ケ月間を経た結果でも、患者の忍容性は高いうえ、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛に著しい軽減とその効果の持続が認められ、有効性も確認できました。現在、第Ⅱ相臨床試験へ向けた準備を進めています。
核酸医薬デコイオリゴDNAのその他の開発については、これまでNF-κBデコイオリゴDNAの次世代型デコイオリゴDNAとして、炎症に関わるNF-κBとSTAT6という2つの重要な転写因子を同時に抑制する働きを持った「キメラデコイ」の開発を進めております。NF-κBのみをターゲットとした従来のデコイオリゴDNAと比較して、より強力で幅広い炎症抑制効果を発揮することが期待されます。
■高血圧治療用DNAワクチン(自社品)
当社グループは、遺伝子治療用製品、核酸医薬につづく遺伝子医薬の第三の事業として、DNAワクチンの開発を手がけており、高血圧治療用DNAワクチンの開発を進めております。オーストラリアでの第Ⅰ/Ⅱa相臨床試験は投与後の初期の試験結果の評価を行ったところ、重篤な有害事象はなく、安全性に問題がないことを確認し、アンジオテンシンⅡに対する抗体産生を認めました。分析結果は、論文としてHypertension Researchに掲載し、第43回日本高血圧学会総会Late Breaking Abstractでも発表いたしました。今後、安全性、免疫原性および有効性を評価する試験を継続的に行ってまいります。
新規研究開発プロジェクト及び新規事業プロジェクト
■ゲノム編集技術による遺伝子治療用製品開発
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社へ追加出資し、完全子会社化しました。Emendo社のゲノム編集技術は、高い効率と精度を両立したゲノム編集を可能にする画期的かつ実用的な独自技術です。現在、Emendoの希少疾患を対象とした開発プロジェクトについて、米国での臨床試験開始に向けた準備を進めています。
■希少遺伝性疾患検査を主目的とした衛生検査所開設
2021年4月に、希少遺伝性疾患検査を主目的とし、川崎生命科学・環境研究センターに衛生検査所を開設し、同年7月より、一般社団法人希少疾患の医療と研究を推進する会(CReARID)が展開する「オプショナルスクリーニング」事業の規模拡大、対象疾患の拡充をサポートする活動を開始いたしました。
■マイクロバイオームを用いた疾患予防・健康維持
当社は、腸内細菌叢を利用した疾患治療薬や健康維持のサプリメントを開発しているイスラエルのMyBiotics Pharma Ltd.と2018年7月に資本提携し、1 人 1 人の健康状態・体質に合った腸内細菌を見つけ出し、それらを含む医薬品やサプリメントを開発することを目指しています。
■Brickell Biotech,Inc.(旧:バイカル社)との戦略的な開発協力
当社と2016年12月に戦略的事業提携を締結したバイカル社は、2019年8月に米国のBrickell Biotech, Inc.との合併契約を締結し、合併後の新社名はBrickell Biotech, Inc.となりました。同社とは2020年9月に新型コロナウイルス感染症予防DNAワクチンの米国での臨床開発に関する共同開発契約を締結しました。
(5) 事業のリスクに記載した重要事象等についての分析及び改善するための対応方法
医薬品事業は、製品化までに多額の資金と長い時間を要する等の特性があり、創薬ベンチャーである当社グループにおいては、継続的な営業損失の発生及び営業キャッシュ・フローのマイナスを計上している状況にあります。そのため、継続企業の前提に重要な疑義を生じさせるような状況が存在しております。
当社グループは当該状況を解消すべく、下記を重要な課題として取り組んでおります。
①自社既存プロジェクトの推進
当社グループでは、2019年3月に国内初の遺伝子治療用製品「コラテジェン®」の条件及び期限付承認を厚生労働省から取得し、同年9月から販売を開始いたしました。現在、製造販売後承認条件評価を行うとともに国内での同製品の適用拡大のための臨床試験及び米国での閉塞性動脈硬化症を対象とした臨床試験を進めております。また、現在海外で臨床試験を進めております椎間板性腰痛症向けの核酸医薬NF-κBデコイオリゴDNA、高血圧DNAワクチンに加え、新型コロナウイルス感染症の世界的な蔓延を機に2020年3月に開発を開始した新型コロナウイルス感染症予防DNAワクチンを含めた4プロジェクトを推進しております。これらのプロジェクトを確実に推進していくことが最優先課題であると考えております。
②開発パイプラインの拡充と事業基盤の拡大
当社グループでは新型コロナウイルス感染症の世界的な蔓延を機に予防用としてのDNAワクチンの開発を2020年3月より開始し、現在高用量製剤での第Ⅰ/Ⅱ相の臨床試験を実施しております。また、ゲノム編集における先進技術を持つEmendo社を完全子会社化し、究極の遺伝子治療ともいわれるゲノム編集で世界に戦いを挑みます。これらの開発パイプラインの拡充や事業基盤の拡大により、当社グループは遺伝子治療の世界でグローバルリーダーを目指します。
今後も、ライセンス導入や共同開発、創薬プラットフォーム技術の獲得を目指した事業提携に加え、他社に対する資本参加や他社の買収等により開発品パイプラインの拡充による事業基盤の拡大を図り、将来の成長を実現してまいります。
③開発プロジェクトにおける提携先の確保
当社グループでは、開発プロジェクトのリスクを低減するために、製薬会社と提携し、契約金・マイルストーンや開発協力金を受け取ることにより財務リスクを低減しながら開発を進めるという提携モデルを基本方針としております。
「コラテジェン®」について日本と米国を対象とした独占的販売契約を田辺三菱製薬と締結しており、マイルストーン収入やロイヤリティー収入が見込めます。また、2019年2月にイスラエルにおけるHGF遺伝子治療用製品「コラテジェン®」の独占的販売権の許諾について同国Kamada社と基本合意書を締結しております。さらに2020年10月にスペシャルティ薬(特定疾患専門薬)を扱うトルコのEr-Kim社と「コラテジェン®」のトルコでの導出(独占的販売権許諾)に関する基本合意書を締結しました。椎間板性腰痛症向けの核酸医薬NF-κBデコイオリゴDNA、高血圧DNAワクチンにつきましては臨床試験が予定どおり進捗しており、製薬企業等への早期導出により契約一時金、ロイヤリティー等を得ることにより、開発費の負担削減と定期的な収入確保を目指してまいります。今後も、製薬会社との提携を進めることにより、事業基盤の強化に努めてまいります。
④資金調達の実施
当社グループにとって、研究開発活動及び事業基盤の拡大を推進することは継続的な発展のために重要であり、そのためには状況に応じ機動的に資金調達を行うことが必要となります。2021年3月8日開催の取締役会において、第41回新株予約権(第三者割当て)(行使価額修正条項付)の発行を決議し、同年5月18日までにすべてが行使され174億74百万円(新株予約権発行による入金を含む)を調達いたしました。今後も、研究開発活動推進及び企業維持のために必要となる資金調達の可能性を適宜検討してまいります。
これら諸施策の実施により、継続企業の前提に関する重要な不確実性は認められないと判断しております。