半期報告書-第26期(2024/01/01-2024/12/31)
(1) 経営成績の分析
当社グループ(当社及び連結子会社3社)は、遺伝子の働きを利用した「遺伝子医薬」の開発、実用化を目指し、研究開発を行う創薬系のバイオベンチャーです。遺伝子医薬のグローバルリーダーを目指して、自社における医薬品の開発及び開発パイプラインの拡充のための国内外企業との共同開発、業務提携、資本参加等を積極的に行っています。また、希少遺伝性疾患の有無を調べるスクリーニング検査や、主に希少疾患向けに海外で販売されていて、日本国内では販売されていない医薬品の国内への導入なども積極的に取り組んでおります。
当中間連結会計期間の事業収益は前年同期に比べ2億96百万円増加し3億47百万円(前年同期比578.5%増)となりました。当社グループでは、HGF遺伝子治療用製品コラテジェンの条件及び期限付製造販売の承認を取得し、2019年9月から田辺三菱製薬より販売しておりました。2023年5月に条件解除に向けた製造販売承認申請を提出いたしましたが、2024年6月に上記承認申請を一旦取り下げ、再度の承認申請を行うべく準備を進めています。この結果、製品売上高は11百万円とほぼ前年並みとなっております。ACRLにおいては、CReARIDが展開する拡大新生児スクリーニングである「オプショナルスクリーニング」を受託しており、前年同期に比べ受託数が順調に増加していることから、手数料収入として1億7百万円(同68百万円の増加)を計上いたしました。また、2024年5月27日より早老症治療薬「ゾキンヴィ」の販売を開始し、1億51百万円の商品売上高を計上しております。さらに、当社連結子会社のEmendo社が開発したゲノム編集のためのOMNIヌクレアーゼの非独占的使用権について、スウェーデンのAnocca社とライセンス契約を締結し、契約一時金を研究開発事業収益として76百万円計上いたしました。
当中間連結会計期間における事業費用は、前年同期に比べ5億46百万円減少し、54億55百万円(同9.1%減)となりました。
売上原価は、前年同期に比べ1億41百万円増加し、1億99百万円(同242.6%増)となりました。コラテジェンにかかる製品売上原価は、前年同期において使用期限切れによる廃棄が見込まれる製品の評価損3百万円を計上していたため、前年同期に比べ3百万円減少し、8百万円(同30.1%減)となっております。ACRLにおける新生児拡大スクリーニング検査にかかる原価は、受託数の増加に伴い前年同期に比べ44百万円増加し、91百万円(同94.9%増)となっております。当中間連結会計期間より販売を開始したゾキンヴィにかかる商品売上原価は、1億円となっております。
研究開発費は、前年同期に比べ9億18百万円減少し、22億45百万円(同29.0%減)となりました。主にEmendo社において、事業再編成に伴う人員の減少により給料手当が3億29百万円、製造関連費用等の減少により外注費が2億33百万円減少しております。使用期限切れによる廃棄が見込まれる材料及びコラテジェンの製品にかかる評価損の計上により、研究用材料費が1億27百万円増加しております。
当社グループのような研究開発型バイオベンチャー企業は先行投資が続きますが、提携戦略などにより財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4) 研究開発活動」をご参照ください。
販売費及び一般管理費は前年同期に比べ2億29百万円増加し、30億9百万円(同8.3%増)となりました。コラテジェンの回収にかかる費用11百万円の計上及びEmendo社の事業再編に伴う弁護士等専門家及びコンサルタントへの報酬の増加により、支払手数料が前年同期より1億29百万円増加しております。為替の円安に伴い、Emendo社買収に伴うのれん償却額が前年同期より1億90百万円増加しております。
この結果、当中間連結会計期間の営業損失は51億7百万円(前年同期の営業損失は59億51百万円)となりました。
営業外損益においては、主にEmendo社への貸付金の評価替を行った結果、円安による為替変動の影響により、為替差益が19億16百万円発生しております(前年同期は10億89百万円の為替差益)。Vasomune社が米国において獲得した助成金について、当社開発費負担分に応じて27百万円を受領し、補助金収入に計上しております(前年同期は74百万円)。
この結果、当中間連結会計期間の経常損失は31億90百万円(前年同期の経常損失は47億76百万円)となりました。
当中間連結会計期間の親会社株主に帰属する中間純損失は35億円(前年同期の親会社株主に帰属する中間純損失は48億30百万円)となりました。Emendo社において、同社の研究開発部門の再編成に伴う事業構造改革費用2億30百万円を特別損失として計上しております。
(2) 財政状態の分析
当中間連結会計期間末の総資産は前連結会計年度末に比べ12億17百万円減少し、276億75百万円となりました。
流動資産は23億30百万円減少し、35億91百万円となっております。2023年7月12日に発行したBofA証券株式会社を割当先とする第43回新株予約権、2024年4月5日に発行したCantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債及び第44回新株予約権についてその一部が行使され、18億76百万円を調達いたしました。現金及び預金は当期事業費用等の支払いにより23億39百万円減少し、18億20百万円となりました。当期より販売を開始したゾキンヴィについて、商品を2億13百万円計上いたしました。使用期限切れによる廃棄が見込まれる材料の評価損の計上により、原材料及び貯蔵品が3億79百万円減少しております。
当中間連結会計期間末の固定資産は11億13百万円増加し、240億84百万円となっております。Emendo社の社屋にかかるリース資産の減損により、使用権資産が1億25百万円減少しております。のれんは、償却により16億68百万円減少しておりますが、円安による為替変動の影響により米ドル建のれんの換算額が28億66百万円増加し、前連結会計年度末に比べ11億97百万円増加して229億43百万円となりました。
当中間連結会計期間末の負債は前連結会計年度末に比べ5億91百万円減少し、21億98百万円となりました。前年度の費用の支払いにより、買掛金が1億46百万円、未払金が1億65百万円減少しております。前年度の消費税の納付により、未払消費税等が93百万円減少しております。Emendo社における事業構造改革費用の支払いにより、事業構造改革引当金が2億52百万円減少しております。
当中間連結会計期間末の純資産は前連結会計年度末に比べ6億25百万円減少し、254億77百万円となりました。BofA証券株式会社を割当先とする第43回新株予約権、Cantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債、第44回新株予約権及びストックオプションの行使により、資本金及び資本剰余金がそれぞれ9億36百万円増加しております。親会社株主に帰属する中間純損失の計上により、利益剰余金が35億円減少しております。主にのれんに係る為替変動の影響により、為替換算調整勘定が9億34百万円増加しております。
(3) キャッシュ・フローの状況
当中間連結会計期間末における現金及び現金同等物(以下、「資金」といいます。)は、前連結会計年度末に比べ24億円減少し、16億91百万円となりました。当中間連結会計期間のキャッシュ・フローの状況は次のとおりです。
(営業活動によるキャッシュ・フロー)
当中間連結会計期間における営業活動による資金の減少は、42億51百万円(前年同期は41億98百万円の減少)となりました。のれん償却費を16億68百万円計上し、棚卸資産が2億63百万円減少しましたが、税金等調整前中間純損失34億18百万円に加え、為替差益を18億96百万円計上し、売上債権が1億73百万円増加、仕入債務が1億63百万円減少、未払金が1億94百万円減少、未収消費税等が1億2百万円増加、未払消費税等が93百万円減少、事業構造改革引当金が3億10百万円減少しております。
(投資活動によるキャッシュ・フロー)
当中間連結会計期間における投資活動による資金の減少は、71百万円(前年同期は3億14百万円の減少)となりました。Emendo社において、拘束性預金の預入による支出51百万円が発生しております。
(財務活動によるキャッシュ・フロー)
当中間連結会計期間における財務活動による資金の増加は、18億43百万円(前年同期は10億55百万円の増加)となりました。Cantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債及び第44回新株予約権の発行により、転換社債型新株予約権付社債の発行による収入が13億円、新株予約権の発行による収入が15百万円となっております。BofA証券を割当先とする第43回新株予約権及びCantor Fitzgerald Europeを割当先とする第44回新株予約権が行使され、新株予約権の行使による株式の発行による収入が5億33百万円となっております。第43回新株予約権につき、新株予約権の買入消却による支出5百万円が発生しております。
(4) 研究開発活動
当中間連結会計期間における研究開発費は前年同期に比べ9億18百万円減少し、22億45百万円(前年同期比29.0%減)となりました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子医薬を中心に医薬品の開発、実用化に取組んでおります。また、究極の遺伝子治療といわれるゲノム編集は、これまで治療の難しかった疾患を対象とした研究開発が進められていますが、当社グループのEmendo社は、独自のゲノム編集技術の開発を進めており、ゲノム編集の分野でも難易度の高い技術を開発しております。
さらに当社は国内外の企業と積極的に提携し、有望な医薬品の実用化に向けて共同開発を進めております。
以下に、当社グループの開発品並びに当社提携先の開発状況についてご説明いたします。
当社の開発プロジェクト
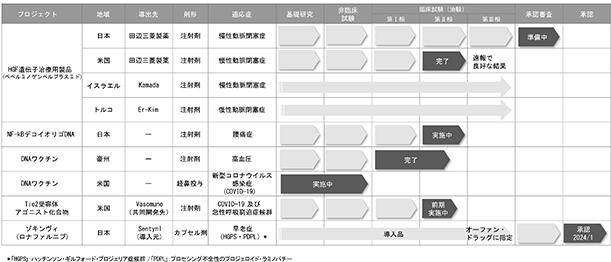
■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
国内におけるHGF遺伝子治療用製品の開発については、慢性動脈閉塞症における潰瘍の改善を効能効果として条件及び期限付承認を取得し、2019年9月より販売しておりました。その後、2023年5月に条件解除に向けた製造販売承認の申請を厚生労働省に提出いたしましたが、2024年6月に上記承認申請を一旦取り下げました。下記米国での後期第Ⅱ相臨床試験の結果と合わせ、今後対象疾患の拡大等を目指して、再度の承認申請の準備を進めてまいります。
米国における開発につきましては、下肢潰瘍を有する閉塞性動脈硬化症を対象とした後期第Ⅱ相臨床試験の投与を2023年第1四半期に完了し、2024年6月に試験結果の速報値により、良好な結果を確認いたしました。今後、試験結果の詳細な分析を進め、米国における今後の開発方針を検討してまいります。なお、試験結果につきましては、本試験を主導した医師が論文として発表する予定であり、当社として具体的な臨床試験結果は、論文発表後にお知らせすることとなります。論文の発表時期は、現時点で決まっておりません。
上記、国内における条件解除に向けた製造販売承認の申請を取り下げたことにより、国内の承認期限が満了となり、これに伴いイスラエルにおける当社の提携先企業Kamada社が提出した製造販売承認申請も取り下げました。また、トルコにおいても、当社提携先企業Er-Kim社の申請に向けた準備が中断することとなります。
■NF-κBデコイオリゴDNA(自社品)
核酸医薬NF-κBデコイオリゴDNAについては、米国において椎間板性腰痛症を対象とした後期第Ⅰ相臨床試験を実施し、投与後の観察期間6ケ月間に続き、12ケ月間を経た結果でも、患者の忍容性は高い上、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛の著しい軽減とその効果の持続が認められ、有効性も確認できました。
2024年中間期は、日本国内における第Ⅱ相臨床試験において順調に症例の登録を進めております。なお、当該試験に関して塩野義製薬株式会社と契約を締結し、費用の一部を負担いただくとともに、試験結果に基づき第Ⅲ相臨床試験の実施について協議する予定です。
■高血圧DNAワクチン(自社品)
高血圧治療用DNAワクチンについては、オーストラリアでの第Ⅰ相/前期第Ⅱ相臨床試験は重篤な有害事象はなく、安全性に問題がないことを確認しました。今後の開発につきましては、新型コロナウイルスのDNAワクチンとは異なるプラスミドDNAの発現に関する改善策などの検討を進めてまいります。
■新型コロナウイルス感染症予防DNAワクチン(自社品)
2020年から2022年まで実施した研究開発の知見を活かし、プラスミドの発現効率や導入効率の向上等、プラットフォームの見直しを行い、並行して、将来発生する可能性のある新たな変異株を視野に入れた改良型DNAワクチン並びにワクチンの経鼻投与製剤の研究を米国スタンフォード大学と共同で実施しております。これまでの研究において薬剤のデリバリーシステムに関する研究に進捗が見られております。
■Tie2受容体アゴニスト(共同開発品)
Tie2受容体アゴニスト(AV-001)は、カナダのバイオ医薬品企業であるVasomune社と共同開発契約を締結し、急性呼吸不全など血管の不全を原因とする疾患を対象に2020年12月より米国において第Ⅰ相臨床試験を実施し、安全性と忍容性を確認いたしました。当初新型コロナウイルス感染症肺炎患者を対象としていましたが、その後、重症化リスクが低いオミクロン株への置き換わりが急速に進んだことに伴い、第Ⅱ相臨床試験の対象疾患をインフルエンザ等のウイルス性及び細菌性肺炎を含む急性呼吸窮迫症候群(ARDS)に広げるべく米国FDAに申請し、承認を受けることができました。2024年中間期は、順調に症例登録を進めており、今後も医療機関との連携を進め今年度内に目標症例数の登録を完了する予定です。
なおAV-001は、本年5月に米国FDAにより重篤な疾患に対する治療薬やアンメットメディカルニーズに対する優秀な医薬品をより早く患者に届けることを目的としたFast Trackに指定をされました。医薬品がFast Track指定を受けると、医薬品開発および審査プロセス全体を通じて、FDAと製薬会社間の早期かつ頻繁なコミュニケーションが可能となります。頻度の高いコミュニケーションにより、質問や問題が迅速に解決され、多くの場合、早期の医薬品承認と患者によるアクセスにつながります。
■ゾキンヴィ(一般名:ロナファルニブ)(導入品)
当社は、2022年5月に米国の医薬品企業であるEiger BioPharmaceuticals Inc.と、ハッチンソン・ギルフォード・プロジェリア症候群とプロセッシング不全性のプロジェロイド・ラミノパチーを適応症とする治療薬であるゾキンヴィについて、日本における独占販売契約を締結いたしました。2023年3月に希少疾病治療薬(オーファン・ドラッグ)の指定を受け、2024年1月に厚生労働省に製造販売承認を取得し、4月17日に薬価基準へ収載されました。そして、この5月27日に販売を開始いたしました。
Emendo社の開発プロジェクト
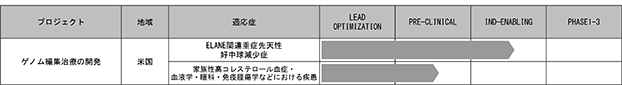
■ゲノム編集技術による遺伝子治療の開発
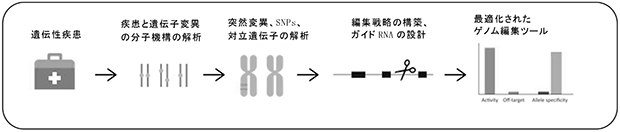
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社を子会社化しました。Emendo社では、ゲノム編集の安全な医療応用を目指し、新規CRISPRヌクレアーゼ(※1)を探索・最適化するプラットフォーム技術(OMNI Platform)を確立しており、ゲノム編集でしばしば問題視される「オフターゲット効果」(※2)を回避できるなど、新たな特徴をもった新規ヌクレアーゼ(OMNI ヌクレアーゼ)を数多く作出し、特許を出願しております。
2024年に入り、知識集約的な研究開発体制に移行するための事業再編成を実施し、Emendo社のイスラエルにある研究施設における研究開発活動の規模をそれに見合ったものとするとともに、米国における研究開発活動及び導出等を進めるための体制づくりを進めております。
この3月14日には、スウェーデンのバイオ企業であるAnocca社と、Emendo社が開発したOMNIヌクレアーゼの非独占的ライセンス契約を締結し、Anocca社が開発しているT細胞受容体改変T細胞(TCR-T)療法による固形がん等の治療にEmendo社の技術が使用されることとなりました。
※1 新規CRISPRヌクレアーゼ:ゲノム編集で使用する新たなRNA誘導型DNA切断酵素で、ガイドRNAで規定した塩基配列を識別し、その標的とした塩基配列を切断する。
※2 オフターゲット効果:ゲノム編集で、DNA鎖上の目的とする塩基配列以外の別の領域に、意図せぬ突然変異を引き起こしてしまうこと。
検査受託サービス及び提携先における開発状況
■希少遺伝性疾患検査を主目的としたACRLの検査受託
ACRLでは現在、一般社団法人希少疾患の医療と研究を推進する会(CReARID)が展開する拡大新生児スクリーニングである「オプショナルスクリーニング」を受託しております。この拡大新生児スクリーニングにおいて陽性となった受検者のうち、偽陽性の受検者を選別するための二次スクリーニング検査方法を開発しており、その成果を2024年2月に米国サンディエゴで開催されたライソゾーム学会で発表いたしました。
これに加え、早老症治療薬ゾキンヴィの発売に伴い、HGPS及びPDPLの遺伝学的検査を受託できる体制を構築し、希少遺伝性疾患の確定のための遺伝学的検査の受託を開始しました。さらに、治療効果をモニタリングするバイオマーカーの検査については、実施体制の構築を進めており、希少遺伝性疾患のスクリーニングから診断、治療に至るまでの包括的な検査体制の提供を目指してまいります。
■マイクロバイオームを用いた治療薬・サプリメントなどの開発
当社は、腸内細菌叢を利用した疾患治療薬や健康維持のサプリメントを開発しているイスラエルのMyBiotics Pharma Ltd.(以下「MyBiotics社」といいます。)と2018年7月に資本提携しております。MyBiotics社では、腸内細菌叢の微生物の構成を再現した培養物(SuperDonor)の製造法を確立しており、クロストリジウム・ディフィシル感染症の治療薬MBX-SD-202の第Ⅰ相臨床試験をイスラエルにおいて完了しております。
当社グループ(当社及び連結子会社3社)は、遺伝子の働きを利用した「遺伝子医薬」の開発、実用化を目指し、研究開発を行う創薬系のバイオベンチャーです。遺伝子医薬のグローバルリーダーを目指して、自社における医薬品の開発及び開発パイプラインの拡充のための国内外企業との共同開発、業務提携、資本参加等を積極的に行っています。また、希少遺伝性疾患の有無を調べるスクリーニング検査や、主に希少疾患向けに海外で販売されていて、日本国内では販売されていない医薬品の国内への導入なども積極的に取り組んでおります。
当中間連結会計期間の事業収益は前年同期に比べ2億96百万円増加し3億47百万円(前年同期比578.5%増)となりました。当社グループでは、HGF遺伝子治療用製品コラテジェンの条件及び期限付製造販売の承認を取得し、2019年9月から田辺三菱製薬より販売しておりました。2023年5月に条件解除に向けた製造販売承認申請を提出いたしましたが、2024年6月に上記承認申請を一旦取り下げ、再度の承認申請を行うべく準備を進めています。この結果、製品売上高は11百万円とほぼ前年並みとなっております。ACRLにおいては、CReARIDが展開する拡大新生児スクリーニングである「オプショナルスクリーニング」を受託しており、前年同期に比べ受託数が順調に増加していることから、手数料収入として1億7百万円(同68百万円の増加)を計上いたしました。また、2024年5月27日より早老症治療薬「ゾキンヴィ」の販売を開始し、1億51百万円の商品売上高を計上しております。さらに、当社連結子会社のEmendo社が開発したゲノム編集のためのOMNIヌクレアーゼの非独占的使用権について、スウェーデンのAnocca社とライセンス契約を締結し、契約一時金を研究開発事業収益として76百万円計上いたしました。
当中間連結会計期間における事業費用は、前年同期に比べ5億46百万円減少し、54億55百万円(同9.1%減)となりました。
売上原価は、前年同期に比べ1億41百万円増加し、1億99百万円(同242.6%増)となりました。コラテジェンにかかる製品売上原価は、前年同期において使用期限切れによる廃棄が見込まれる製品の評価損3百万円を計上していたため、前年同期に比べ3百万円減少し、8百万円(同30.1%減)となっております。ACRLにおける新生児拡大スクリーニング検査にかかる原価は、受託数の増加に伴い前年同期に比べ44百万円増加し、91百万円(同94.9%増)となっております。当中間連結会計期間より販売を開始したゾキンヴィにかかる商品売上原価は、1億円となっております。
研究開発費は、前年同期に比べ9億18百万円減少し、22億45百万円(同29.0%減)となりました。主にEmendo社において、事業再編成に伴う人員の減少により給料手当が3億29百万円、製造関連費用等の減少により外注費が2億33百万円減少しております。使用期限切れによる廃棄が見込まれる材料及びコラテジェンの製品にかかる評価損の計上により、研究用材料費が1億27百万円増加しております。
当社グループのような研究開発型バイオベンチャー企業は先行投資が続きますが、提携戦略などにより財務リスクの低減を図りながら、今後も研究開発投資を行っていく予定です。研究開発の詳細については、本報告書「(4) 研究開発活動」をご参照ください。
販売費及び一般管理費は前年同期に比べ2億29百万円増加し、30億9百万円(同8.3%増)となりました。コラテジェンの回収にかかる費用11百万円の計上及びEmendo社の事業再編に伴う弁護士等専門家及びコンサルタントへの報酬の増加により、支払手数料が前年同期より1億29百万円増加しております。為替の円安に伴い、Emendo社買収に伴うのれん償却額が前年同期より1億90百万円増加しております。
この結果、当中間連結会計期間の営業損失は51億7百万円(前年同期の営業損失は59億51百万円)となりました。
営業外損益においては、主にEmendo社への貸付金の評価替を行った結果、円安による為替変動の影響により、為替差益が19億16百万円発生しております(前年同期は10億89百万円の為替差益)。Vasomune社が米国において獲得した助成金について、当社開発費負担分に応じて27百万円を受領し、補助金収入に計上しております(前年同期は74百万円)。
この結果、当中間連結会計期間の経常損失は31億90百万円(前年同期の経常損失は47億76百万円)となりました。
当中間連結会計期間の親会社株主に帰属する中間純損失は35億円(前年同期の親会社株主に帰属する中間純損失は48億30百万円)となりました。Emendo社において、同社の研究開発部門の再編成に伴う事業構造改革費用2億30百万円を特別損失として計上しております。
(2) 財政状態の分析
当中間連結会計期間末の総資産は前連結会計年度末に比べ12億17百万円減少し、276億75百万円となりました。
流動資産は23億30百万円減少し、35億91百万円となっております。2023年7月12日に発行したBofA証券株式会社を割当先とする第43回新株予約権、2024年4月5日に発行したCantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債及び第44回新株予約権についてその一部が行使され、18億76百万円を調達いたしました。現金及び預金は当期事業費用等の支払いにより23億39百万円減少し、18億20百万円となりました。当期より販売を開始したゾキンヴィについて、商品を2億13百万円計上いたしました。使用期限切れによる廃棄が見込まれる材料の評価損の計上により、原材料及び貯蔵品が3億79百万円減少しております。
当中間連結会計期間末の固定資産は11億13百万円増加し、240億84百万円となっております。Emendo社の社屋にかかるリース資産の減損により、使用権資産が1億25百万円減少しております。のれんは、償却により16億68百万円減少しておりますが、円安による為替変動の影響により米ドル建のれんの換算額が28億66百万円増加し、前連結会計年度末に比べ11億97百万円増加して229億43百万円となりました。
当中間連結会計期間末の負債は前連結会計年度末に比べ5億91百万円減少し、21億98百万円となりました。前年度の費用の支払いにより、買掛金が1億46百万円、未払金が1億65百万円減少しております。前年度の消費税の納付により、未払消費税等が93百万円減少しております。Emendo社における事業構造改革費用の支払いにより、事業構造改革引当金が2億52百万円減少しております。
当中間連結会計期間末の純資産は前連結会計年度末に比べ6億25百万円減少し、254億77百万円となりました。BofA証券株式会社を割当先とする第43回新株予約権、Cantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債、第44回新株予約権及びストックオプションの行使により、資本金及び資本剰余金がそれぞれ9億36百万円増加しております。親会社株主に帰属する中間純損失の計上により、利益剰余金が35億円減少しております。主にのれんに係る為替変動の影響により、為替換算調整勘定が9億34百万円増加しております。
(3) キャッシュ・フローの状況
当中間連結会計期間末における現金及び現金同等物(以下、「資金」といいます。)は、前連結会計年度末に比べ24億円減少し、16億91百万円となりました。当中間連結会計期間のキャッシュ・フローの状況は次のとおりです。
(営業活動によるキャッシュ・フロー)
当中間連結会計期間における営業活動による資金の減少は、42億51百万円(前年同期は41億98百万円の減少)となりました。のれん償却費を16億68百万円計上し、棚卸資産が2億63百万円減少しましたが、税金等調整前中間純損失34億18百万円に加え、為替差益を18億96百万円計上し、売上債権が1億73百万円増加、仕入債務が1億63百万円減少、未払金が1億94百万円減少、未収消費税等が1億2百万円増加、未払消費税等が93百万円減少、事業構造改革引当金が3億10百万円減少しております。
(投資活動によるキャッシュ・フロー)
当中間連結会計期間における投資活動による資金の減少は、71百万円(前年同期は3億14百万円の減少)となりました。Emendo社において、拘束性預金の預入による支出51百万円が発生しております。
(財務活動によるキャッシュ・フロー)
当中間連結会計期間における財務活動による資金の増加は、18億43百万円(前年同期は10億55百万円の増加)となりました。Cantor Fitzgerald Europeを割当先とする第1回無担保転換社債型新株予約権付社債及び第44回新株予約権の発行により、転換社債型新株予約権付社債の発行による収入が13億円、新株予約権の発行による収入が15百万円となっております。BofA証券を割当先とする第43回新株予約権及びCantor Fitzgerald Europeを割当先とする第44回新株予約権が行使され、新株予約権の行使による株式の発行による収入が5億33百万円となっております。第43回新株予約権につき、新株予約権の買入消却による支出5百万円が発生しております。
(4) 研究開発活動
当中間連結会計期間における研究開発費は前年同期に比べ9億18百万円減少し、22億45百万円(前年同期比29.0%減)となりました。
当社グループは、“遺伝子医薬のグローバルリーダー”を目指し、遺伝子医薬を中心に医薬品の開発、実用化に取組んでおります。また、究極の遺伝子治療といわれるゲノム編集は、これまで治療の難しかった疾患を対象とした研究開発が進められていますが、当社グループのEmendo社は、独自のゲノム編集技術の開発を進めており、ゲノム編集の分野でも難易度の高い技術を開発しております。
さらに当社は国内外の企業と積極的に提携し、有望な医薬品の実用化に向けて共同開発を進めております。
以下に、当社グループの開発品並びに当社提携先の開発状況についてご説明いたします。
当社の開発プロジェクト

■HGF遺伝子治療用製品(一般名:ベペルミノゲンペルプラスミド)(自社品)
国内におけるHGF遺伝子治療用製品の開発については、慢性動脈閉塞症における潰瘍の改善を効能効果として条件及び期限付承認を取得し、2019年9月より販売しておりました。その後、2023年5月に条件解除に向けた製造販売承認の申請を厚生労働省に提出いたしましたが、2024年6月に上記承認申請を一旦取り下げました。下記米国での後期第Ⅱ相臨床試験の結果と合わせ、今後対象疾患の拡大等を目指して、再度の承認申請の準備を進めてまいります。
米国における開発につきましては、下肢潰瘍を有する閉塞性動脈硬化症を対象とした後期第Ⅱ相臨床試験の投与を2023年第1四半期に完了し、2024年6月に試験結果の速報値により、良好な結果を確認いたしました。今後、試験結果の詳細な分析を進め、米国における今後の開発方針を検討してまいります。なお、試験結果につきましては、本試験を主導した医師が論文として発表する予定であり、当社として具体的な臨床試験結果は、論文発表後にお知らせすることとなります。論文の発表時期は、現時点で決まっておりません。
上記、国内における条件解除に向けた製造販売承認の申請を取り下げたことにより、国内の承認期限が満了となり、これに伴いイスラエルにおける当社の提携先企業Kamada社が提出した製造販売承認申請も取り下げました。また、トルコにおいても、当社提携先企業Er-Kim社の申請に向けた準備が中断することとなります。
■NF-κBデコイオリゴDNA(自社品)
核酸医薬NF-κBデコイオリゴDNAについては、米国において椎間板性腰痛症を対象とした後期第Ⅰ相臨床試験を実施し、投与後の観察期間6ケ月間に続き、12ケ月間を経た結果でも、患者の忍容性は高い上、重篤な有害事象も認められず、安全性を確認できました。さらに、探索的にデータを評価したところ、患者の腰痛の著しい軽減とその効果の持続が認められ、有効性も確認できました。
2024年中間期は、日本国内における第Ⅱ相臨床試験において順調に症例の登録を進めております。なお、当該試験に関して塩野義製薬株式会社と契約を締結し、費用の一部を負担いただくとともに、試験結果に基づき第Ⅲ相臨床試験の実施について協議する予定です。
■高血圧DNAワクチン(自社品)
高血圧治療用DNAワクチンについては、オーストラリアでの第Ⅰ相/前期第Ⅱ相臨床試験は重篤な有害事象はなく、安全性に問題がないことを確認しました。今後の開発につきましては、新型コロナウイルスのDNAワクチンとは異なるプラスミドDNAの発現に関する改善策などの検討を進めてまいります。
■新型コロナウイルス感染症予防DNAワクチン(自社品)
2020年から2022年まで実施した研究開発の知見を活かし、プラスミドの発現効率や導入効率の向上等、プラットフォームの見直しを行い、並行して、将来発生する可能性のある新たな変異株を視野に入れた改良型DNAワクチン並びにワクチンの経鼻投与製剤の研究を米国スタンフォード大学と共同で実施しております。これまでの研究において薬剤のデリバリーシステムに関する研究に進捗が見られております。
■Tie2受容体アゴニスト(共同開発品)
Tie2受容体アゴニスト(AV-001)は、カナダのバイオ医薬品企業であるVasomune社と共同開発契約を締結し、急性呼吸不全など血管の不全を原因とする疾患を対象に2020年12月より米国において第Ⅰ相臨床試験を実施し、安全性と忍容性を確認いたしました。当初新型コロナウイルス感染症肺炎患者を対象としていましたが、その後、重症化リスクが低いオミクロン株への置き換わりが急速に進んだことに伴い、第Ⅱ相臨床試験の対象疾患をインフルエンザ等のウイルス性及び細菌性肺炎を含む急性呼吸窮迫症候群(ARDS)に広げるべく米国FDAに申請し、承認を受けることができました。2024年中間期は、順調に症例登録を進めており、今後も医療機関との連携を進め今年度内に目標症例数の登録を完了する予定です。
なおAV-001は、本年5月に米国FDAにより重篤な疾患に対する治療薬やアンメットメディカルニーズに対する優秀な医薬品をより早く患者に届けることを目的としたFast Trackに指定をされました。医薬品がFast Track指定を受けると、医薬品開発および審査プロセス全体を通じて、FDAと製薬会社間の早期かつ頻繁なコミュニケーションが可能となります。頻度の高いコミュニケーションにより、質問や問題が迅速に解決され、多くの場合、早期の医薬品承認と患者によるアクセスにつながります。
■ゾキンヴィ(一般名:ロナファルニブ)(導入品)
当社は、2022年5月に米国の医薬品企業であるEiger BioPharmaceuticals Inc.と、ハッチンソン・ギルフォード・プロジェリア症候群とプロセッシング不全性のプロジェロイド・ラミノパチーを適応症とする治療薬であるゾキンヴィについて、日本における独占販売契約を締結いたしました。2023年3月に希少疾病治療薬(オーファン・ドラッグ)の指定を受け、2024年1月に厚生労働省に製造販売承認を取得し、4月17日に薬価基準へ収載されました。そして、この5月27日に販売を開始いたしました。
Emendo社の開発プロジェクト

■ゲノム編集技術による遺伝子治療の開発
当社は、究極の遺伝子治療法ともいわれるゲノム編集技術を用いた遺伝子疾患治療に挑むため、2020年12月にゲノム編集における先進技術及びそれを活用した開発パイプラインを持つEmendo社を子会社化しました。Emendo社では、ゲノム編集の安全な医療応用を目指し、新規CRISPRヌクレアーゼ(※1)を探索・最適化するプラットフォーム技術(OMNI Platform)を確立しており、ゲノム編集でしばしば問題視される「オフターゲット効果」(※2)を回避できるなど、新たな特徴をもった新規ヌクレアーゼ(OMNI ヌクレアーゼ)を数多く作出し、特許を出願しております。
2024年に入り、知識集約的な研究開発体制に移行するための事業再編成を実施し、Emendo社のイスラエルにある研究施設における研究開発活動の規模をそれに見合ったものとするとともに、米国における研究開発活動及び導出等を進めるための体制づくりを進めております。
この3月14日には、スウェーデンのバイオ企業であるAnocca社と、Emendo社が開発したOMNIヌクレアーゼの非独占的ライセンス契約を締結し、Anocca社が開発しているT細胞受容体改変T細胞(TCR-T)療法による固形がん等の治療にEmendo社の技術が使用されることとなりました。

※1 新規CRISPRヌクレアーゼ:ゲノム編集で使用する新たなRNA誘導型DNA切断酵素で、ガイドRNAで規定した塩基配列を識別し、その標的とした塩基配列を切断する。
※2 オフターゲット効果:ゲノム編集で、DNA鎖上の目的とする塩基配列以外の別の領域に、意図せぬ突然変異を引き起こしてしまうこと。
検査受託サービス及び提携先における開発状況
■希少遺伝性疾患検査を主目的としたACRLの検査受託
ACRLでは現在、一般社団法人希少疾患の医療と研究を推進する会(CReARID)が展開する拡大新生児スクリーニングである「オプショナルスクリーニング」を受託しております。この拡大新生児スクリーニングにおいて陽性となった受検者のうち、偽陽性の受検者を選別するための二次スクリーニング検査方法を開発しており、その成果を2024年2月に米国サンディエゴで開催されたライソゾーム学会で発表いたしました。
これに加え、早老症治療薬ゾキンヴィの発売に伴い、HGPS及びPDPLの遺伝学的検査を受託できる体制を構築し、希少遺伝性疾患の確定のための遺伝学的検査の受託を開始しました。さらに、治療効果をモニタリングするバイオマーカーの検査については、実施体制の構築を進めており、希少遺伝性疾患のスクリーニングから診断、治療に至るまでの包括的な検査体制の提供を目指してまいります。
■マイクロバイオームを用いた治療薬・サプリメントなどの開発
当社は、腸内細菌叢を利用した疾患治療薬や健康維持のサプリメントを開発しているイスラエルのMyBiotics Pharma Ltd.(以下「MyBiotics社」といいます。)と2018年7月に資本提携しております。MyBiotics社では、腸内細菌叢の微生物の構成を再現した培養物(SuperDonor)の製造法を確立しており、クロストリジウム・ディフィシル感染症の治療薬MBX-SD-202の第Ⅰ相臨床試験をイスラエルにおいて完了しております。